
【题目】钛白粉(TiO2)作为白色颜料和增白剂,广泛用于油漆、造纸等工业生产中。一种以钛铁矿(含FeTiO3及少量的CaO、Fe2O3、SiO2)为原料生产钛白粉的工艺流程如图:
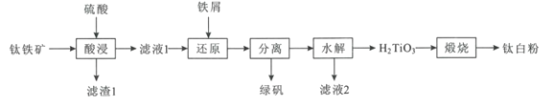
回答下列问题:
(1)“酸浸”是用硫酸在温度为150~200℃下溶煮钛铁矿,“滤液1”中的主要成分中含有TiOSO4,则“酸浸”中主要发生的反应方程式为___。
(2)“滤渣1”的主要成分有___。
(3)“还原"中加入过量铁屑的目的是___。
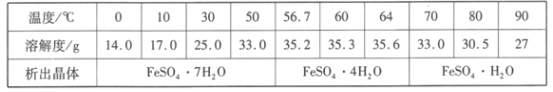
(4)硫酸亚铁晶体的溶解度如下表所示,其中绿矾(FeSO4·7H2O)容易被氧化,则“分离”得到绿矾的操作为___。
(5)“水解”需要加热至90℃的目的是___。
(6)“滤液2”可返回到___工序循环利用。
(7)工业上将钛白粉与焦炭、氯气共热生成TiCl4和一种可燃气体,反应的化学方程式为___,最后在氩气氛围和加热的条件下用金属镁还原TiCl4制取性能优越的金属钛。
【答案】FeTiO3+2H2SO4![]() TiOSO4+FeSO4+2H2O SiO2、CaSO4 将溶液中的Fe3+还原为Fe2+,防止Fe2+被氧化 真空加热浓缩,低于50℃降温结晶,过滤(洗涤) 升高温度,促进TiOSO4的水解 酸浸 TiO2+2Cl2+2C
TiOSO4+FeSO4+2H2O SiO2、CaSO4 将溶液中的Fe3+还原为Fe2+,防止Fe2+被氧化 真空加热浓缩,低于50℃降温结晶,过滤(洗涤) 升高温度,促进TiOSO4的水解 酸浸 TiO2+2Cl2+2C![]() TiCl4+2CO
TiCl4+2CO
【解析】
根据流程和题意有:FeTiO3及少量的CaO、Fe2O3、SiO2,加入硫酸后生成TiOSO4、FeSO4、Fe2(SO4)3和微溶的CaSO4,SiO2不反应;滤液1中加入铁粉将三价铁转化为二价铁,再将绿矾FeSO47H2O分离出来,TiOSO4经过水解后得到H2TiO3和硫酸,最后煅烧得到钛白粉(TiO2)。
(1)钛铁矿FeTiO3中铁为+2价,则FeTiO3与硫酸反应生成TiOSO4和FeSO4,结合反应条件和质量守恒定律,则“酸浸”中主要发生的反应方程式为FeTiO3+2H2SO4![]() TiOSO4+FeSO4+2H2O;
TiOSO4+FeSO4+2H2O;
(2)根据分析,与硫酸反应后生成的CaSO4微溶,SiO2与硫酸不反应,则 “滤渣1”的主要成分有SiO2、CaSO4;
(3)滤液1中有Fe2(SO4)3,后面要得到绿矾FeSO47H2O,加入铁屑能将溶液中的Fe3+还原为Fe2+,同时Fe2+易被氧化,加入铁屑能防止Fe2+被氧化,所以加入过量铁屑的目的是将溶液中的Fe3+还原为Fe2+,防止Fe2+被氧化;
(4)根据溶解度表,高于50℃时得不到FeSO4·7H2O,所以降温结晶温度不能高于50℃,二价铁不稳定,具有还原性,易被空气中的氧气氧化为三价铁,所以得到绿矾的操作为真空加热浓缩,低于50℃降温结晶,过滤(洗涤);
(5)水解时吸热,升高温度,能促进水解,所以需要加热至90℃的目的是升高温度,促进TiOSO4的水解;
(6)TiOSO4水解时生成H2TiO3和硫酸,故“滤液2”中含有硫酸,可返回到酸浸工序循环利用。
(7)钛白粉与焦炭、氯气共热生成TiCl4和一种可燃气体是CO,反应物有TiO2、Cl2、C,生成物有TiCl4、CO,配平后得到反应的化学方程式为TiO2+2Cl2+2C![]() TiCl4+2CO。
TiCl4+2CO。


科目:高中化学 来源: 题型:
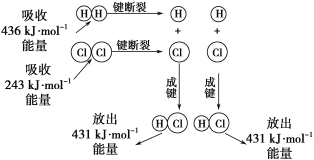
【题目】在25℃、101kPa的条件下,断裂1molH—H键吸收436kJ能量,断裂1molCl—Cl键吸收243kJ能量,形成1molH-Cl键放出431 kJ能量。H2+Cl2=2HCl的化学反应可用如图表示:
请回答下列有关问题:
(1)反应物断键吸收的总能量为___________________。
(2)生成物成键放出的总能量为______________。
(3)判断H2+Cl2=2HCl反应_____________(填“吸收”或“放出”)能量。
(4)反应物的总能量________(填“>”、“=”或“<”)生成物的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均为短周期元素,原子序数依次增大,请根据表中信息回答下列问题:
元素 | 元素性质或结构 |
A | 最外层电子数是其内层电子数的2倍 |
B | B元素的单质在空气中含量最多 |
C | C元素在地壳中含量最多 |
D | D元素在同周期中金属性最强 |
E | 常温常压下,E元素形成的单质是淡黄色固体,常在火山口附近沉积 |
(1)E在元素周期表中的位置_____________.
(2)D的最高价氧化物的水化物电子式___________,所含化学键类型____________.
(3)B、C、D、E简单离子半径由大到小顺序为_____________(用离子符号表示).
(4)由A、B、C与氢元素组成的一种常见酸式盐与过量D的最高价氧化物的水化物反应的离子方程式:_____________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是国民经济发展的重要材料,铝在地壳中的含量约占8%,目前我国铝消费量超过430万吨,在众多的金属中仅次于铁。请回答下问题:
(Ⅰ)实验室中用金属铝制备少量氢氧化铝,有以下3种方案:
方案1:Al![]() Al3+
Al3+![]() Al(OH)3↓
Al(OH)3↓
方案2:Al![]() AlO
AlO![]()
![]() Al(OH)3↓
Al(OH)3↓
方案3: ―→Al(OH)3
―→Al(OH)3
制备相同物质的量的氢氧化铝消耗酸和碱最少的是方案________。
(Ⅱ)工业上冶炼铝的流程图如图所示:

在制取氧化铝的过程中,分析铝土矿和赤泥中所含Al2O3、Fe2O3质量分数的数据如下:

(1)书写化学方程式,反应①________,反应②________。
(2)电解氧化铝生产铝时,阳极的电极反应式为_______________________________________。
(3)假设其他杂质不参加反应,则每生产3.4 t纯净的氧化铝,需铝土矿________t。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于钢铁冶炼的说法错误的是( )
①焦炭在炼铁中的作用是产生还原剂和热量
②炼钢中用纯氧代替空气做氧化剂,是为了防止产生污染
③炼铁高炉有两个进口、三个出口
④用含硫较多的生铁炼钢,应加入较多的生石灰
⑤炼铁、炼钢过程中都发生CaO+SiO2![]() CaSiO3
CaSiO3
⑥尽管铁的熔点是1 535 ℃,但高炉中的铁在1 200 ℃左右就呈液态
⑦生铁炼钢的主要目的调节硅锰等的含量、除去硫磷
A. ①⑥ B. ②⑦ C. ③⑤ D. ④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研团队报道了以LiAlCl4离子液体作为电解质的铝离子二次电池,其放电工作原理如图所示。下列说法错误的是( )
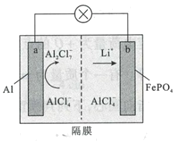
A.充电时,b极质量减小
B.放电时,阴离子向a极移动
C.充电时,正极反应为4Al2C1![]() +3e-=Al+7AlCl4
+3e-=Al+7AlCl4
D.放电时,阴极反应为FePO4+Li++e-=LiFePO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若含有1 mol铁离子和1 mol铝离子的混合溶液,现按下图横坐标依次加入8 mol 氢氧化钠溶液、1 mol盐酸,通入1 mol 二氧化碳气体,纵坐标为混合沉淀的物质的量。
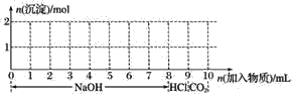
(1)请画出沉淀的量随反应的变化曲线______________。
(2)并写出加入氢氧化钠6 mol及其后发生的各步反应的离子方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中书写正确的是( )
A. 水玻璃中通入过量的二氧化碳: Na2SiO3+CO2+H2O===2Na++CO![]() +H2SiO3
+H2SiO3
B. 澄清石灰水中通入过量二氧化碳:Ca(OH)2+2CO2===Ca2++2HCO![]()
C. 二氧化硅与氢氟酸反应:SiO2+4H++4F-===SiF4↑+2H2O
D. 二氧化硅溶于烧碱溶液中:SiO2+2OH-===SiO![]() +H2O
+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写正确的是( )
A.向Na2S2O3溶液中通入足量氯气:S2O![]() +4Cl2+5H2O=2SO
+4Cl2+5H2O=2SO![]() +8Cl-+10H+
+8Cl-+10H+
B.向AlCl3溶液中加入足量氨水:Al3++4NH3·H2O=AlO![]() +4NH
+4NH![]() +2H2O
+2H2O
C.向碳酸氢铵溶液中加入足量石灰水:Ca2++HCO![]() +OH-=CaCO3↓+H2O
+OH-=CaCO3↓+H2O
D.在海带灰的浸出液(含有I-)中滴加H2O2得到I2:2I-+H2O2+2H+=I2+O2↑+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com