
【题目】若含有1 mol铁离子和1 mol铝离子的混合溶液,现按下图横坐标依次加入8 mol 氢氧化钠溶液、1 mol盐酸,通入1 mol 二氧化碳气体,纵坐标为混合沉淀的物质的量。
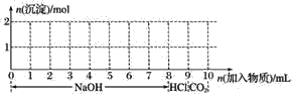
(1)请画出沉淀的量随反应的变化曲线______________。
(2)并写出加入氢氧化钠6 mol及其后发生的各步反应的离子方程式______________。
【答案】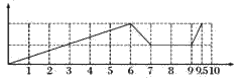 Al(OH)3+OH-=[Al(OH)4]-;H++OH-=H2O;CO2+[Al(OH)4]-=Al(OH)3↓+HCO3-;CO2+CO32-+H2O=2HCO3-
Al(OH)3+OH-=[Al(OH)4]-;H++OH-=H2O;CO2+[Al(OH)4]-=Al(OH)3↓+HCO3-;CO2+CO32-+H2O=2HCO3-
【解析】
混合溶液中,加入6 mol氢氧化钠能使1 mol铁离子和1 mol铝离子完全转化为沉淀,再加1 mol氢氧化钠时,氢氧化铝完全溶解生成Na[Al(OH)4],离子反应为Al(OH)3+OH-= [Al(OH)4]-+2H2O;7~8 mol时加氢氧化钠不发生反应,8~9 mol时加盐酸,发生酸碱中和,H++OH-=H2O;9~9.5 mol时通入二氧化碳气体,四羟基合铝酸根离子完全转化为氢氧化铝沉淀,CO2+[Al(OH)4]-=Al(OH)3↓+HCO3-;9.5~10 mol继续通入二氧化碳气体,溶液中碳酸根离子转化为碳酸氢根离子,CO2+CO32-+H2O=2 HCO3-,据此分析。
混合溶液中,加入6 mol氢氧化钠能使1 mol铁离子和1 mol铝离子完全转化为沉淀,再加1 mol氢氧化钠时,氢氧化铝完全溶解生成Na[Al(OH)4],离子反应为Al(OH)3+OH-= [Al(OH)4]-+2H2O;7~8 mol时加氢氧化钠不发生反应,8~9 mol时加盐酸,发生酸碱中和,H++OH-=H2O;9~9.5 mol时通入二氧化碳气体,四羟基合铝酸根离子完全转化为氢氧化铝沉淀,CO2+[Al(OH)4]-=Al(OH)3↓+HCO3-;9.5~10 mol继续通入二氧化碳气体,溶液中碳酸根离子转化为碳酸氢根离子,CO2+CO32-+H2O=2 HCO3-。
(1)沉淀的量随反应的变化曲线为 ;
;
(2)加入氢氧化钠6 mol及其后发生的各步反应的离子方程式分别为Al(OH)3+OH-=[Al(OH)4]-、H++OH-=H2O;CO2+[Al(OH)4]-=Al(OH)3↓+HCO3-、CO2+CO32-+H2O=2HCO3-。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.环戊二烯(![]() )分子中所有原子共平面
)分子中所有原子共平面
B.同主族元素含氧酸的酸性随核电荷数的增加而减弱
C.二甲醚易溶于水,氨基乙酸的熔点较高,主要原因都与氢键有关
D.NO![]() 离子中心原子上的孤电子对数是0,立体构型为平面三角形
离子中心原子上的孤电子对数是0,立体构型为平面三角形
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
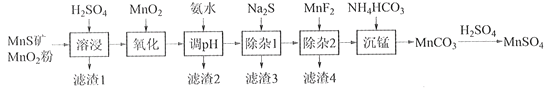
相关金属离子[c0(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和__________________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式____________________________________________________。
(2)“氧化”中添加适量的MnO2的作用是将________________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是_____________________________________________________________________。
(6)写出“沉锰”的离子方程式___________________________________________________。
(7)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnz2,其中Ni、Co、Mn的化合价分别为+2、+3、+4。当x=y=![]() 时,z=___________。
时,z=___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛白粉(TiO2)作为白色颜料和增白剂,广泛用于油漆、造纸等工业生产中。一种以钛铁矿(含FeTiO3及少量的CaO、Fe2O3、SiO2)为原料生产钛白粉的工艺流程如图:
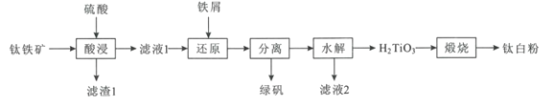
回答下列问题:
(1)“酸浸”是用硫酸在温度为150~200℃下溶煮钛铁矿,“滤液1”中的主要成分中含有TiOSO4,则“酸浸”中主要发生的反应方程式为___。
(2)“滤渣1”的主要成分有___。
(3)“还原"中加入过量铁屑的目的是___。
(4)硫酸亚铁晶体的溶解度如下表所示,其中绿矾(FeSO4·7H2O)容易被氧化,则“分离”得到绿矾的操作为___。
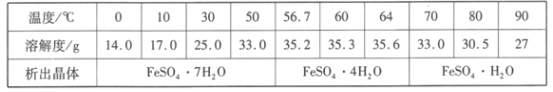
(5)“水解”需要加热至90℃的目的是___。
(6)“滤液2”可返回到___工序循环利用。
(7)工业上将钛白粉与焦炭、氯气共热生成TiCl4和一种可燃气体,反应的化学方程式为___,最后在氩气氛围和加热的条件下用金属镁还原TiCl4制取性能优越的金属钛。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组利用电导率(电导率越大,导电能力越强)传感器、pH传感器探究NaHCO3和CaCl2能否发生化学反应。向25.00mL0.1mol·L-1NaHCO3溶液中滴入等体积、等浓度CaCl2溶液,电导率以及pH变化曲线如图所示。下列说法错误的是( )
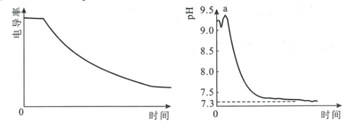
A.电导率下降的原因是生成了CaCO3沉淀导致溶液中离子浓度降低
B.a点后pH下降的原因是Ca2+促进HCO3![]() H++CO
H++CO![]() 平衡右移
平衡右移
C.pH=7.3时,溶液中溶质主要为NaCl、CaCl2
D.可用0.1mol·L-1CaCl2溶液鉴别浓度均为0.1mol·L-1的NaHCO3和Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的过程是目前直接利用太阳能的研究热点。人们把通过人工光化学手段合成燃料的过程叫做人工光合作用。
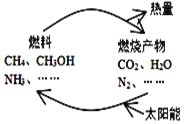
(1)在图构想的物质和能量循环中太阳能最终转化为______能;
(2)人工光合作用的途径之一就是在催化剂和光照条件下,将CO2和H2O转化为CH3OH(甲醇),该反应的化学方程式为:2CO2(g)+4H2O(g) ![]() 2CH3OH(g)+3O2(g)。一定条件下,在2 L密闭容器中进行上述反应,下列能说明该反应已达到平衡状态的是____________(填序号);
2CH3OH(g)+3O2(g)。一定条件下,在2 L密闭容器中进行上述反应,下列能说明该反应已达到平衡状态的是____________(填序号);
A.v正(H2O)=2v逆(CO2) B.n(CH3OH)∶n(O2)=2∶3
C.容器内压强保持不变 D.容器内混合气体密度保持不变
(3)①用人工光合作用得到的甲醇、氧气和稀硫酸制作燃料电池,则甲醇应通入该燃料电池的______极(填“正”或“负”),通入氧气一极的电极反应式:_________。
②若用氢氧化钾溶液作电解液制成甲醇燃料电池,其负极的电极反应式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双氯芬酸钠(G)是常用的抗炎镇痛药,一种合成路线如图(-Ph为苯基):
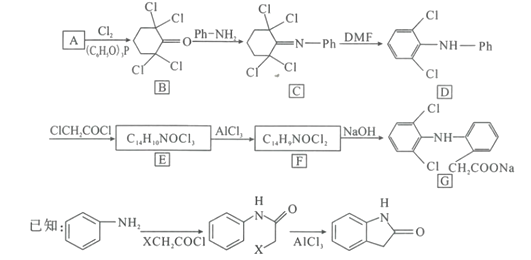
回答下列问题:
(1)9.8gA完全燃烧生成26.4gCO2和9.0gH2O,且A的核磁共振氢谱中有3组峰,峰面积之比为1:2:2,则A的结构简式是___。
(2)B中的官能团名称是___。
(3)E到F的反应类型是___。
(4)写出F到G的反应方程式___。
(5)能发生银镜反应且为环状结构的A的同分异构体多达14种,写出其中只含一条侧链且侧链上的一氯代物为2种的结构简式___(不考虑立体异构)。
(6)设计由2—丙醇和对苯二胺(![]() )制备
)制备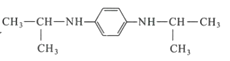 的合成路线___(无机试剂任选)。
的合成路线___(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在地壳内SiO2和HF存在以下平衡:SiO2(s)+4HF(g)![]() SiF4(g)+2H2O(g),△H= +148.9 kJ。如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,()
SiF4(g)+2H2O(g),△H= +148.9 kJ。如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,()
A.2v(正、HF)=v(逆、H2O)B.v(H2O)=2v(SiF4)
C.SiO2的质量保持不变D.反应物不再转化为生成物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在同温同压下,下列各组热化学方程式中,△H2>△H1的是
A.2H2(g)+O2(g)=2H2O(g) ΔH1;2H2(g)+O2(g)=2H2O(l) ΔH2
B.S(s)+O2(g)=SO2(g) ΔH1; S(g)+O2(g)=SO2(g) ΔH2
C.![]() ΔH1;C(s)+O2(g)=CO2(g) ΔH2
ΔH1;C(s)+O2(g)=CO2(g) ΔH2
D.H2(g)+Cl2(g)=2HCl(g) ΔH1; ![]() ΔH2
ΔH2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com