
【题目】如图所示的过程是目前直接利用太阳能的研究热点。人们把通过人工光化学手段合成燃料的过程叫做人工光合作用。
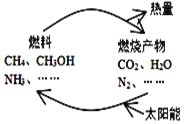
(1)在图构想的物质和能量循环中太阳能最终转化为______能;
(2)人工光合作用的途径之一就是在催化剂和光照条件下,将CO2和H2O转化为CH3OH(甲醇),该反应的化学方程式为:2CO2(g)+4H2O(g) ![]() 2CH3OH(g)+3O2(g)。一定条件下,在2 L密闭容器中进行上述反应,下列能说明该反应已达到平衡状态的是____________(填序号);
2CH3OH(g)+3O2(g)。一定条件下,在2 L密闭容器中进行上述反应,下列能说明该反应已达到平衡状态的是____________(填序号);
A.v正(H2O)=2v逆(CO2) B.n(CH3OH)∶n(O2)=2∶3
C.容器内压强保持不变 D.容器内混合气体密度保持不变
(3)①用人工光合作用得到的甲醇、氧气和稀硫酸制作燃料电池,则甲醇应通入该燃料电池的______极(填“正”或“负”),通入氧气一极的电极反应式:_________。
②若用氢氧化钾溶液作电解液制成甲醇燃料电池,其负极的电极反应式为________________。
【答案】热 AC 负 O2+4H++4e-=2H2O CH3OH-6e-+8OH-=CO32-+6H2O
【解析】
(1)根据图示分析判断;
(2)达到平衡时正逆反应速率相等,各物质的浓度、含量不变,据此分析判断;
(3)①在燃料电池中,通入燃料甲醇的电极是负极、通入氧气的电极是正极;②若用氢氧化钾溶液作电解液制成甲醇燃料电池,甲醇在负极发生氧化反应生成碳酸钾,据此书写电极反应式。
(1)由图可知,太阳能首先转化为化学能,其次化学能转化为热能,因此在图构想的物质和能量循环中太阳能最终转化为热能,故答案为:热;
(2)A.v正(H2O)=2v逆(CO2),可说明正逆反应速率相等,达到平衡状态,故A正确;
B.无论是否达到平衡状态,生成物的物质的量之比都等于化学计量数之比,即n(CH3OH)∶(O2)=2∶3,故B错误;
C.反应前后气体的体积不等,容器内压强保持不变,可说明达到平衡状态,故C正确;
D.因容器体积以及气体的质量不变,则容器内密度保持不变,不能用于判断是否达到平衡状态,故D错误;
故答案为:AC;
(3)①甲醇、氧气和稀硫酸制作燃料电池,反应中甲醇被氧化,应为电池的负极,正极发生还原反应,氧气被还原生成水,电极方程式为O2+4H++4e-=2H2O,故答案为:负;O2+4H++4e-=2H2O;
②若用氢氧化钾溶液作电解液制成甲醇燃料电池,甲醇在负极发生氧化反应生成碳酸钾,电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O,故答案为:CH3OH-6e-+8OH-=CO32-+6H2O。


科目:高中化学 来源: 题型:
【题目】恒容密闭容器中发生反应C(s)+H2O(g)![]() CO(g)+H2(g),下列状态中不能表明该反应达到平衡状态的是( )
CO(g)+H2(g),下列状态中不能表明该反应达到平衡状态的是( )
A.断裂氢氧键速率是断裂氢氢键速率的2倍
B.混合气体平均相对分子质量不再改变
C.单位时间内消耗水与生成氢气的质量比为9∶1
D.混合气体的物质的量不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是国民经济发展的重要材料,铝在地壳中的含量约占8%,目前我国铝消费量超过430万吨,在众多的金属中仅次于铁。请回答下问题:
(Ⅰ)实验室中用金属铝制备少量氢氧化铝,有以下3种方案:
方案1:Al![]() Al3+
Al3+![]() Al(OH)3↓
Al(OH)3↓
方案2:Al![]() AlO
AlO![]()
![]() Al(OH)3↓
Al(OH)3↓
方案3: ―→Al(OH)3
―→Al(OH)3
制备相同物质的量的氢氧化铝消耗酸和碱最少的是方案________。
(Ⅱ)工业上冶炼铝的流程图如图所示:

在制取氧化铝的过程中,分析铝土矿和赤泥中所含Al2O3、Fe2O3质量分数的数据如下:

(1)书写化学方程式,反应①________,反应②________。
(2)电解氧化铝生产铝时,阳极的电极反应式为_______________________________________。
(3)假设其他杂质不参加反应,则每生产3.4 t纯净的氧化铝,需铝土矿________t。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研团队报道了以LiAlCl4离子液体作为电解质的铝离子二次电池,其放电工作原理如图所示。下列说法错误的是( )
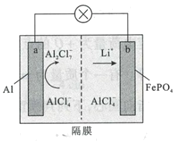
A.充电时,b极质量减小
B.放电时,阴离子向a极移动
C.充电时,正极反应为4Al2C1![]() +3e-=Al+7AlCl4
+3e-=Al+7AlCl4
D.放电时,阴极反应为FePO4+Li++e-=LiFePO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若含有1 mol铁离子和1 mol铝离子的混合溶液,现按下图横坐标依次加入8 mol 氢氧化钠溶液、1 mol盐酸,通入1 mol 二氧化碳气体,纵坐标为混合沉淀的物质的量。
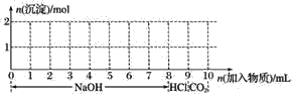
(1)请画出沉淀的量随反应的变化曲线______________。
(2)并写出加入氢氧化钠6 mol及其后发生的各步反应的离子方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿的主要成分是氧化铝(Al2O3),在工业上是采用电解氧化铝的方法得出金属铝。
(1)在氧化铝中铝元素与氧元素的质量之比是__________?
(2)用两种方法计算用170 t含氧化铝80%的铝土矿,理论上可冶炼出金属铝__________吨?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中书写正确的是( )
A. 水玻璃中通入过量的二氧化碳: Na2SiO3+CO2+H2O===2Na++CO![]() +H2SiO3
+H2SiO3
B. 澄清石灰水中通入过量二氧化碳:Ca(OH)2+2CO2===Ca2++2HCO![]()
C. 二氧化硅与氢氟酸反应:SiO2+4H++4F-===SiF4↑+2H2O
D. 二氧化硅溶于烧碱溶液中:SiO2+2OH-===SiO![]() +H2O
+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】判断A(g)+B(g) ![]() C(g)+D(g)是否达到平衡的依据为( )
C(g)+D(g)是否达到平衡的依据为( )
A. 压强不随时间改变
B. 气体的密度不随时间改变
C. c(A)不随时间改变
D. 单位时间里生成C和D的物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知C(s、金刚石)+O2(g)![]() CO2(g);ΔH=-395.4 kJ·mol-1,C(s、石墨)+O2(g)
CO2(g);ΔH=-395.4 kJ·mol-1,C(s、石墨)+O2(g)![]() CO2(g);ΔH=-393.5 kJ·mol-1。
CO2(g);ΔH=-393.5 kJ·mol-1。
①石墨和金刚石相比,石墨的稳定性_________金刚石的稳定性。
②石墨中C-C键键能________金刚石中C-C键键能。(均填“大于” “小于”或“等于”)。
(2)将4g CH4完全燃烧生成气态CO2和液态水,放出热量222.5 kJ,其热化学反应方程式为:______________________________________________________。
(3)0.5mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,其热化学反应方程式为:______________________________________________。
(4)已知下列反应的反应热:
CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1=+206.2kJ·mol-1
CO(g)+3H2(g) △H1=+206.2kJ·mol-1
CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) △H2=-247.4 kJ·mol-1
2CO(g)+2H2(g) △H2=-247.4 kJ·mol-1
则CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式______________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com