
【题目】在地壳内SiO2和HF存在以下平衡:SiO2(s)+4HF(g)![]() SiF4(g)+2H2O(g),△H= +148.9 kJ。如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,()
SiF4(g)+2H2O(g),△H= +148.9 kJ。如果上述反应在体积不变的密闭容器中发生,当反应达到平衡时,()
A.2v(正、HF)=v(逆、H2O)B.v(H2O)=2v(SiF4)
C.SiO2的质量保持不变D.反应物不再转化为生成物
 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E均为短周期元素,原子序数依次增大,请根据表中信息回答下列问题:
元素 | 元素性质或结构 |
A | 最外层电子数是其内层电子数的2倍 |
B | B元素的单质在空气中含量最多 |
C | C元素在地壳中含量最多 |
D | D元素在同周期中金属性最强 |
E | 常温常压下,E元素形成的单质是淡黄色固体,常在火山口附近沉积 |
(1)E在元素周期表中的位置_____________.
(2)D的最高价氧化物的水化物电子式___________,所含化学键类型____________.
(3)B、C、D、E简单离子半径由大到小顺序为_____________(用离子符号表示).
(4)由A、B、C与氢元素组成的一种常见酸式盐与过量D的最高价氧化物的水化物反应的离子方程式:_____________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若含有1 mol铁离子和1 mol铝离子的混合溶液,现按下图横坐标依次加入8 mol 氢氧化钠溶液、1 mol盐酸,通入1 mol 二氧化碳气体,纵坐标为混合沉淀的物质的量。
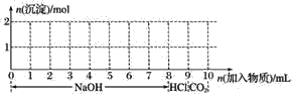
(1)请画出沉淀的量随反应的变化曲线______________。
(2)并写出加入氢氧化钠6 mol及其后发生的各步反应的离子方程式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中书写正确的是( )
A. 水玻璃中通入过量的二氧化碳: Na2SiO3+CO2+H2O===2Na++CO![]() +H2SiO3
+H2SiO3
B. 澄清石灰水中通入过量二氧化碳:Ca(OH)2+2CO2===Ca2++2HCO![]()
C. 二氧化硅与氢氟酸反应:SiO2+4H++4F-===SiF4↑+2H2O
D. 二氧化硅溶于烧碱溶液中:SiO2+2OH-===SiO![]() +H2O
+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计如下微型实验装置。实验时,现断开K2,闭合K1,两极均有气泡产生;一段时间后,断开K1,闭合K2,发现电流表指针偏转,下列有关描述正确的是

A. 断开K2,闭合K1时,总反应的离子方程式为:2H++2Cl—![]() Cl2↑+H2↑
Cl2↑+H2↑
B. 断开K2,闭合K1时,石墨电极附近溶液变红
C. 断开K1,闭合K2时,铜电极上的电极反应为:Cl2+2e—=2Cl—
D. 断开K1,闭合K2时,石墨电极作正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】判断A(g)+B(g) ![]() C(g)+D(g)是否达到平衡的依据为( )
C(g)+D(g)是否达到平衡的依据为( )
A. 压强不随时间改变
B. 气体的密度不随时间改变
C. c(A)不随时间改变
D. 单位时间里生成C和D的物质的量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“瑞德西韦(Remdesivir)”对新型冠状病毒(SARS-CoV-2)有明显的抑制作用,其合成路线如下:
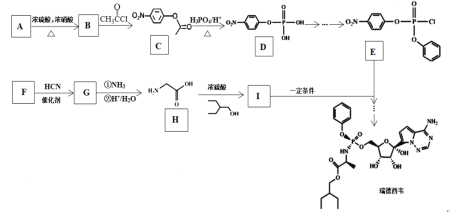
已知:![]()
(1)有机物G中官能团名称是________、_________。
(2)有机物H的化学名称为____________。
(3)A到B的反应类型是___________。
(4)有机物F的结构简式是__________。
(5)写出由B到C的反应方程式_________________。
(6)有机物M是C的一种同分异构体,满足下列条件的同分异构体有___种;其中核磁共振氢谱有4组峰,峰面积之比为2:2:2:1的结构简式为____________。
①苯环上有3个取代基 ②能发生银镜反应
③不能与FeCl3发生显色反应 ④能发生水解反应,且1 mol M消耗4 mol NaOH
(7)设计由苯甲醇为原料制备化合物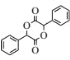 的合成路线______(无机试剂任选)。
的合成路线______(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写正确的是( )
A.向Na2S2O3溶液中通入足量氯气:S2O![]() +4Cl2+5H2O=2SO
+4Cl2+5H2O=2SO![]() +8Cl-+10H+
+8Cl-+10H+
B.向AlCl3溶液中加入足量氨水:Al3++4NH3·H2O=AlO![]() +4NH
+4NH![]() +2H2O
+2H2O
C.向碳酸氢铵溶液中加入足量石灰水:Ca2++HCO![]() +OH-=CaCO3↓+H2O
+OH-=CaCO3↓+H2O
D.在海带灰的浸出液(含有I-)中滴加H2O2得到I2:2I-+H2O2+2H+=I2+O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,将1.0L c mol·L-1 CH3COOH溶液与0.1mol NaOH固体混合,使之充分反应。然后向该混合溶液中通入HCl气体或加入NaOH固体(忽略体积和温度变化),溶液pH随通入(或加入)物质的物质的量的变化如图所示。下列叙述错误的是( )
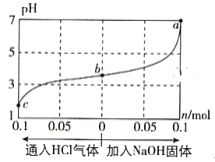
A. 水的电离程度:a>b>c
B. c点对应的混合溶液中:c(CH3COOH)>c(Na+)>c(OH-)
C. a点对应的混合溶液中:c(Na+)=c(CH3COO-)
D. 该温度下,CH3COOH的电离平衡常数![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com