
【题目】已知:4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H= -1025kJ/mol,若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( )
4NO(g)+6H2O(g) △H= -1025kJ/mol,若反应物起始物质的量相同,下列关于该反应的示意图不正确的是( )
A.  B.
B. 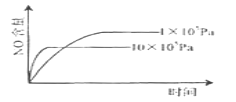
C.  D.
D. 
【答案】C
【解析】
4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) △H= -1025kJ/mol,为放热反应,且正反应气体体积增大,利用勒夏特列原理分析解题。
4NO(g)+6H2O(g) △H= -1025kJ/mol,为放热反应,且正反应气体体积增大,利用勒夏特列原理分析解题。
A.从1000℃升温到1200℃, NO的含量降低,平衡逆向移动;温度升高,向吸热反应方向移动,逆反应为吸热反应,符合反应事实,A项不符合题意;
B. 从105Pa升压到106Pa,NO的含量降低,平衡逆向移动;压强增大,向气体体积减小的方向移动,符合反应事实,B项不符合题意;
C.从1000℃升温到1200℃,NO的含量增加,平衡正向移动;温度升高,向吸热反应方向移动,吸热反应为逆反应,不符合反应事实,C项符合题意;
D.1000℃有催化剂比无催化剂更快达到平衡,但是NO的含量一样,平衡没有移动。催化剂不改变平衡的移动,但是可以加快化学反应速率,符合反应事实,D项不符合题意;
本题答案选C。


科目:高中化学 来源: 题型:
【题目】下图为元素在生物体内的含量分布情况,下列表述不正确的是( )
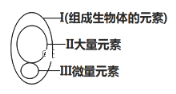
A. Ⅰ在非生物界中都能找到,体现了生物界与非生物界的统一性
B. Ⅲ含量虽少,却是生物体正常生命活动不可缺少的
C. Ⅱ和Ⅲ为生物体的必需元素,一旦缺乏就可能会导致相应的病症
D. P、S、K、Ca、Zn属于大量元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组用黄铜矿(主要成分是CuFeS2,其中S为-2价)为主要原料炼铜,其总反应为:2CuFeS2+2SiO2+5O2=2Cu+2FeSiO3+4SO2。事实上该反应是按如下流程分步进行的:
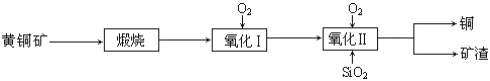
(1)氧化Ⅰ的反应主要是煅烧生成的硫化亚铁被进一步氧化为氧化亚铁,并与二氧化硅反应生成矿渣。矿渣的主要成分是(填化学式)_____________________。
(2)据报道,有一种细菌在氧气存在下可以将黄铜矿氧化成硫酸盐,反应是在酸性溶液中发生的。该反应的化学方程式为____________________。
(3)我国学者研究发现,以精CuFeS2矿为原料在沸腾炉中与O2(空气)反应,生成物冷却后经溶解、除铁、结晶,得到CuSO4·5H2O,生产成本能够降低许多。有关实验结果如下表:
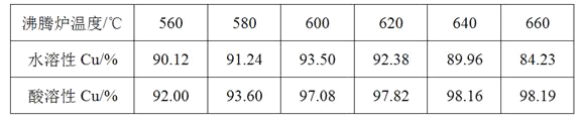
①CuFeS2与O2反应的化学方程式为______________________。
②实际生产过程中沸腾炉温度为600~620 ℃。则控制温度的方法是_______________。
③当温度高于600~620 ℃时,生成物中水溶性铜下降的原因是____________。
④生成物冷却后的除铁的实验操作方法主要是_________。已知在溶液中,Cu2+开始沉淀和沉淀完全的pH分别为4.7、6.7,Fe3+开始沉淀和沉淀完全的pH分别为1.1、3.2;如果制得的硫酸铜溶液中含有少量的Fe3+,请写出除去溶液中Fe3+的实验操作步骤:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
近年来,随着聚酯工业的快速发展,氯气的需求量和氯化氢的产出量也随之迅速增长。因此,将氯化氢转化为氯气的技术成为科学研究的热点。回答下列问题:
(1)Deacon发明的直接氧化法为:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。下图为刚性容器中,进料浓度比c(HCl) ∶c(O2)分别等于1∶1、4∶1、7∶1时HCl平衡转化率随温度变化的关系:
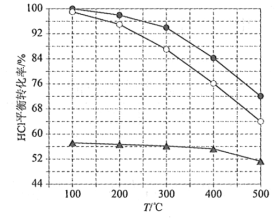
可知反应平衡常数K(300℃)____________K(400℃)(填“大于”或“小于”)。设HCl初始浓度为c0,根据进料浓度比c(HCl)∶c(O2)=1∶1的数据计算K(400℃)=____________(列出计算式)。按化学计量比进料可以保持反应物高转化率,同时降低产物分离的能耗。进料浓度比c(HCl)∶c(O2)过低、过高的不利影响分别是____________。
(2)Deacon直接氧化法可按下列催化过程进行:
CuCl2(s)=CuCl(s)+![]() Cl2(g) ΔH1=83 kJ·mol-1
Cl2(g) ΔH1=83 kJ·mol-1
CuCl(s)+![]() O2(g)=CuO(s)+
O2(g)=CuO(s)+![]() Cl2(g) ΔH2=-20 kJ·mol-1
Cl2(g) ΔH2=-20 kJ·mol-1
CuO(s)+2HCl(g)=CuCl2(s)+H2O(g) ΔH3=-121 kJ·mol-1
则4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)的ΔH=_________ kJ·mol-1。
(3)在一定温度的条件下,进一步提高HCI的转化率的方法是______________。(写出2种)
(4)在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:
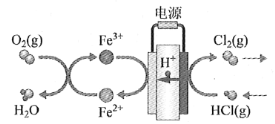
负极区发生的反应有____________________(写反应方程式)。电路中转移1 mol电子,需消耗氧气__________L(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D四种短周期元素,A分别与B、C、D结合生成甲、乙、丙三种化合物,且甲、乙、丙三分子中含相同数目的质子数,C、D结合生成化合物丁。有关元素的单质和甲、乙、丙、丁四种化合物的转化关系如下图所示:

(1)写出B+乙―→甲+C的化学反应方程式___________________________
(2)根据以上条件可以确定A、B、C、D四种元素中的三种,不能被确定的第四种元素是________。(填写序号) ①A ②B ③C ④D
(3)依据下列条件可以进一步确定上述第四种元素:①甲与丙以及乙与丙均能够发生反应,②甲、丙都是无色、有刺激性气味的物质。
据此,请回答下列问题:写出上述第四种元素在周期表中第_______周期第_______族;写出C+丙―→乙+丁的化学反应方程式_________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的排列顺序是
①20 mL 0.01 mol/L KCl溶液 ②30 mL 0.02 mol/L CaCl2溶液
③40 mL 0.03 mol/L HCl溶液 ④10 mL 蒸馏水⑤50 mL 0.05 mol/L AgNO3溶液
A. ①>②>③>④>⑤ B. ④>①>③>②>⑤
C. ⑤>④>②>①>③ D. ④>③>⑤>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4.铝土矿的主要成分为氧化铝、氧化铁和二氧化硅,工业上经过下列工艺可以冶炼金属铝:

下列说法中错误的是( )
A. ①②中除加试剂外,还需要进行过滤操作
B. a、b中铝元素的化合价相同
C. ③中需要通入过量的氨气
D. ④进行的操作是加热,而且d一定是氧化铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~G是前四周期除稀有气体之外原子序数依次增大的七种元素。A与其他元素既不同周期又不同族;B、C的价电子层中未成对电子数都是2;E核外的s、p能级的电子总数相等;F与E同周期且第一电离能比E小;G的+1价离子(G+)的各层电子全充满。回答下列问题:
(1)写出元素名称:B_______,G_______。
(2)写出F的价电子排布图:_______。
(3)写出化合物BC的结构式:__________________。
(4)由A、C、F三元素形成的离子[F(CA)4]— 是F在水溶液中的一种存在形式,其中F的杂化类型是________________。
(5)在测定A、D形成的化合物的相对分子质量时,实验测定值一般高于理论值的主要原因是______________________。
(6)E的一种晶体结构如图甲,则其一个晶胞中含有_______个E;G与D形成的化合物的晶胞结构如图乙,若晶体密度为ag/cm3,则G与D最近的距离为____pm
(阿伏加德罗常数用NA表示,列出计算表达式,不用化简;乙中○为G,●为D。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关晶体的结构如图所示,下列说法中不正确的是 ( )


A. 在NaCl晶体中,距Na+最近的Cl-形成正八面体
B. 在CaF2晶体中,每个晶胞平均占有4个Ca2+
C. 在金刚石晶体中,碳原子与碳碳键个数的比为1∶2
D. 该气态团簇分子的分子式为EF或FE
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com