
【题目】(15分)铜是一种重要的有色金属,近年来用途越来越广泛。请回答下列问题:
(1)下列四种化合物中含铜量最高的是______(填字母)
A.Cu5FeS4 B.CuFeS2 C.Cu2S D.Cu2(OH)2CO3
(2)2014年我国精炼铜产量796万吨,若全部由含Cu2S质量分数为32%的铜矿石冶炼得到,则需要铜矿石质量为________万吨。(保留一位小数)
(3)可溶性铜盐常用于生产其它含铜化合物。在KOH溶液中加入一定量的CuSO4溶液,再加入一定量的还原剂——肼(N2H4),加热并保持温度在90℃,生成一种对环境无污染的气体,反应完全后,分离,洗涤,真空干燥得到纳米氧化亚铜固体(Cu2O)。
①该制备过程的反应方程式为____________________________________________。
②工业上常用的固液分离设备有________(填字母)
A.离心机 B.分馏塔 C.框式压滤机 D.反应釜
(4)我国出土的青铜器工艺精湛,具有很高的艺术价值和历史价值。但出土的青铜器大多受到环境腐蚀。右图是青铜器在潮湿环境中发生电化学腐蚀的原理示意图:

①腐蚀过程中,负极是____(填“a”“b”或“c”),正极反应方程式为_______________。
②环境中的Cl-扩散到孔口,并与正极产物和负极产物生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为_______________________。
【答案】
(1) C
(2)3109.4
(3)①4CuSO4+N2H4+8KOH ![]() 2Cu2O+N2↑+4K2SO4+6H2O ;②AC
2Cu2O+N2↑+4K2SO4+6H2O ;②AC
(4)①c,O2+2H2O+4e-=4OH-;②Cl-+2Cu2++3OH-==Cu2(OH)3Cl↓
【解析】
试题分析:(1)A.Cu5FeS4中含铜量为![]() =0.63;B.CuFeS2中含铜量为
=0.63;B.CuFeS2中含铜量为![]() =0.35;C.铜量为
=0.35;C.铜量为![]() =0.8;D.Cu2(OH)2CO3中含铜量为
=0.8;D.Cu2(OH)2CO3中含铜量为![]() =0.58,故答案为:C;
=0.58,故答案为:C;
(2)Cu2S中铜元素的质量分数=![]() ×100%=80%;则X吨含Cu2S 32%的铜矿石中含铜元素质量=Xt×80%×32%=796万t,解得X=3109.4万吨,故答案为:3109.4;
×100%=80%;则X吨含Cu2S 32%的铜矿石中含铜元素质量=Xt×80%×32%=796万t,解得X=3109.4万吨,故答案为:3109.4;
(3)①由题意可知碱性条件下硫酸铜和N2H4发生氧化还原反应,反应的化学方程式为4CuSO4+N2H4+8KOH ![]() 2Cu2O+N2↑+4K2SO4+6H2O,故答案为:4CuSO4+N2H4+8KOH
2Cu2O+N2↑+4K2SO4+6H2O,故答案为:4CuSO4+N2H4+8KOH ![]() 2Cu2O+N2↑+4K2SO4+6H2O;
2Cu2O+N2↑+4K2SO4+6H2O;
②工业上常用的固液分离设备有离心机和框式压滤机,故答案为:AC;
(4)①根据图知,氧气得电子生成氢氧根离子、Cu失电子生成铜离子,发生吸氧腐蚀,则Cu作负极,即c是负极,正极发生还原反应,电极方程式为O2+2H2O+4e-═4OH-,故答案为:c;O2+2H2O+4e-═4OH-;
②Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔粉状锈Cu2(OH)3Cl,负极上生成铜离子、正极上生成氢氧根离子,所以该离子反应为氯离子、铜离子和氢氧根离子反应生成Cu2(OH)3Cl沉淀,离子方程式为2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓,故答案为:2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】随原子序数的递增,八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。

根据判断出的元素回答问题:
(1)d在元素周期表的位置是__________。
(2)d、e、f常见简单离子的半径由大到小为___________(用化学式表示,下同);y、f、g、h的最高价氧化物对应的水化物的酸性由强到弱是:______________________________。
(3)用电子式表示由x和g两种元素形成的化合物的形成过程____________________。由x、y、d三种元素形成的相对分子质量最小的化合物可作为燃料电池的燃料,以KOH溶液为电解质溶液,写出负极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食品干燥剂在食品加工、储存中应用非常广泛。食品干燥剂应无毒、无味、无腐蚀性及对环境友好。下列说法错误的是
A.硅胶可用作食品干燥剂
B.P2O5不可用作食品干燥
C.六水氯化钙可用作食品干燥剂
D.加工后具有吸水性的植物纤维可用作食品干燥剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸钠(![]() ,缩写为NaA)可用作饮料的防腐剂。研究表明苯甲酸(HA)的抑菌能力显著高于A-。已知25℃时,HA的Ka=6.25×10-5,H2CO3的Ka1=4.17×10-7,Ka2=4.90×10-11,在生产碳酸饮料的过程中,除了添加NaA外,还需加压冲入CO2气体,下列说法正确的是(温度为25℃,不考虑饮料中其他成分)
,缩写为NaA)可用作饮料的防腐剂。研究表明苯甲酸(HA)的抑菌能力显著高于A-。已知25℃时,HA的Ka=6.25×10-5,H2CO3的Ka1=4.17×10-7,Ka2=4.90×10-11,在生产碳酸饮料的过程中,除了添加NaA外,还需加压冲入CO2气体,下列说法正确的是(温度为25℃,不考虑饮料中其他成分)
A.相比于未充CO2的饮料,碳酸饮料的抑菌能力较低
B.提高CO2充气压力,饮料中c(A-)不变
C.当pH为5.0时,饮料中![]() =0.16
=0.16
D.碳酸饮料中各种粒子的浓度关系为:c(H+)=c(HCO3-)+c(CO32-)+c(OH-)-c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或记录正确的是
A. 常温常压下测得1 mol N2的质量为28 g
B. 用量筒测得排水法收集制得的氢气的体积为50.28 mL
C. 用两只250 mL的容量瓶配制0.1 mol·L-1500 mL的NaOH溶液
D. 用托盘天平称得2.50 g胆矾,受热充分失水后,固体质量减轻0.90 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸铈[Ce2(CO3)3]为白色粉末,难溶于水,主要用作生产铈的中间化合物。它可由氟碳酸铈精矿经如下流程制得。
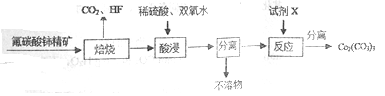
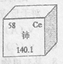
(1)如图是一种稀土元素铈(Ce)在元素周期表中的信息示意图。则铈原子的质子数是______,氟碳酸铈的化学式为CeFCO3,该化合物中,Ce的化合价为_____________;
(2)焙烧生成的铈化合物为二氧化铈(CeO2),其在酸浸时发生反应的离子方程式为______________;
(3)试剂X______________;
(4)已知298K时,Ksp[Ce(OH)4]=1×10-29,Ce(OH)4的溶度积表达式为Ksp=______________;为了使溶液中Ce4+沉淀完全,需调节pH为________以上;
(5)取某Ce(OH)4产品1.00g(质量分数为97%),加硫酸溶解后,用0.1000molL-1的FeSO4溶液滴定至终点(铈被还原成Ce3+)则需要滴加标准溶液的体积____________mL,若用硫酸酸化后改用0.1000molL-1
的FeCl2溶液滴定产品从而测定Ce(OH)4产品的质量分数,其它操作都正确,则测定的Ce(OH)4产品的质量分数__________(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)铜、铁都是日常生活中常见的金属,它们的单质及其化合物在科学研究和工农业生产中具有广泛用途。
请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:
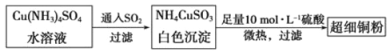
①Cu2+的价电子排布图 ;NH4CuSO3中N、O、S三种元素的第一电离能由大到小顺序为________(填元素符号)。
②SO42-的空间构型为 ,SO32-离子中心原子的杂化方式为 。
(2)请写出向Cu(NH3)4SO4水溶液中通入SO2时发生反应的离子方程式 。
(3)某学生向CuSO4溶液中加入少量氨水生成蓝色沉淀,继续加入过量氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体。
①下列说法正确的是
a.氨气极易溶于水,是因为NH3分子和H2O分子之间形成3种不同的氢键
b.NH3分子和H2O分子,分子空间构型不同,氨气分子的键角小于水分子的键角
c.Cu(NH3)4SO4所含有的化学键有离子键、极性共价键和配位键
d.Cu(NH3)4SO4组成元素中电负性最大的是氮元素
②请解释加入乙醇后析出晶体的原因 。
(4)Cu晶体的堆积方式如图所示,设Cu原子半径为r,晶体中Cu原子的配位数为 ,晶体的空间利用率为 (列式)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com