
【题目】(14分)铜、铁都是日常生活中常见的金属,它们的单质及其化合物在科学研究和工农业生产中具有广泛用途。
请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:
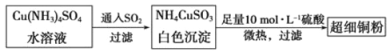
①Cu2+的价电子排布图 ;NH4CuSO3中N、O、S三种元素的第一电离能由大到小顺序为________(填元素符号)。
②SO42-的空间构型为 ,SO32-离子中心原子的杂化方式为 。
(2)请写出向Cu(NH3)4SO4水溶液中通入SO2时发生反应的离子方程式 。
(3)某学生向CuSO4溶液中加入少量氨水生成蓝色沉淀,继续加入过量氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体。
①下列说法正确的是
a.氨气极易溶于水,是因为NH3分子和H2O分子之间形成3种不同的氢键
b.NH3分子和H2O分子,分子空间构型不同,氨气分子的键角小于水分子的键角
c.Cu(NH3)4SO4所含有的化学键有离子键、极性共价键和配位键
d.Cu(NH3)4SO4组成元素中电负性最大的是氮元素
②请解释加入乙醇后析出晶体的原因 。
(4)Cu晶体的堆积方式如图所示,设Cu原子半径为r,晶体中Cu原子的配位数为 ,晶体的空间利用率为 (列式)。

【答案】(1)①![]() ;N>O>S;②正四面体,sp2;
;N>O>S;②正四面体,sp2;
(2)2Cu(NH3)42++3SO2+4H2O=2NH4CuSO3↓+6NH4+ +SO42-;
(3)①c; ②一水合硫酸四氨合铜在乙醇中溶解度较小。
(4)12 ;74.76% 。
【解析】
试题分析:(1)①Cu是29号元素,Cu2+的价层电子数是9个,所以Cu2+价电子排布图是![]() ;N、O、S三种元素中由于N原子的2p轨道是半充满状态,所以第一电离能最大;同主族元素,随电子层数的增多,第一电离能逐渐减小,所以3种元素的第一电离能由大到小顺序为:N>O>S;②SO42-的价层电子对数=4+1/2(6+2-4×2)=4,所以空间构型为正四面体型;SO32-离子的价层电子对数=3+1/2(6+2-3×2)=4,所以中心原子的杂化方式为sp3杂化;(2)由流程图可知向[Cu(NH3)4]SO4水溶液中通入SO2时生成白色沉淀,根据所给沉淀的化学式书写离子方程式,所以离子方程式为:2Cu(NH3)42++3SO2+4H2O=2NH4CuSO3↓+6NH4+ +SO42-;(3)①a.氨气极易溶于水,是因为NH3分子和H2O分子之间形成2种不同的氢键,N与H,O与H之间,错误;b.NH3分子和H2O分子,分子空间构型不同,氨气是三角锥型,水是角形,氨气分子的键角大于水分子的键角,错误;c.Cu(NH3)4 SO4所含有的化学键有离子键、极性共价键和配位键,硫酸根离子与配离子之间是离子键,N与H之间是共价键,氨气与铜离子之间是配位键,正确;d.Cu(NH3)4 SO4组成元素中电负性最大的是氧元素,错误;②根据相似相容原理,极性分子易溶于极性溶剂,乙醇分子极性比水分子极性弱,加入乙醇降低溶剂的极性,从而减小溶质的溶解度;(4)Cu晶体的堆积方式是面心立方最密堆积,所以配位数是12;由图可知,立方体的面的对角线长是4r,所以立方体的棱长
;N、O、S三种元素中由于N原子的2p轨道是半充满状态,所以第一电离能最大;同主族元素,随电子层数的增多,第一电离能逐渐减小,所以3种元素的第一电离能由大到小顺序为:N>O>S;②SO42-的价层电子对数=4+1/2(6+2-4×2)=4,所以空间构型为正四面体型;SO32-离子的价层电子对数=3+1/2(6+2-3×2)=4,所以中心原子的杂化方式为sp3杂化;(2)由流程图可知向[Cu(NH3)4]SO4水溶液中通入SO2时生成白色沉淀,根据所给沉淀的化学式书写离子方程式,所以离子方程式为:2Cu(NH3)42++3SO2+4H2O=2NH4CuSO3↓+6NH4+ +SO42-;(3)①a.氨气极易溶于水,是因为NH3分子和H2O分子之间形成2种不同的氢键,N与H,O与H之间,错误;b.NH3分子和H2O分子,分子空间构型不同,氨气是三角锥型,水是角形,氨气分子的键角大于水分子的键角,错误;c.Cu(NH3)4 SO4所含有的化学键有离子键、极性共价键和配位键,硫酸根离子与配离子之间是离子键,N与H之间是共价键,氨气与铜离子之间是配位键,正确;d.Cu(NH3)4 SO4组成元素中电负性最大的是氧元素,错误;②根据相似相容原理,极性分子易溶于极性溶剂,乙醇分子极性比水分子极性弱,加入乙醇降低溶剂的极性,从而减小溶质的溶解度;(4)Cu晶体的堆积方式是面心立方最密堆积,所以配位数是12;由图可知,立方体的面的对角线长是4r,所以立方体的棱长![]() 1个Cu的体积是4πr3/3,晶胞中Cu原子的个数是4个,所以晶体的空间利用率为4×4πr3/3÷a3=74.76%。
1个Cu的体积是4πr3/3,晶胞中Cu原子的个数是4个,所以晶体的空间利用率为4×4πr3/3÷a3=74.76%。


科目:高中化学 来源: 题型:
【题目】(15分)铜是一种重要的有色金属,近年来用途越来越广泛。请回答下列问题:
(1)下列四种化合物中含铜量最高的是______(填字母)
A.Cu5FeS4 B.CuFeS2 C.Cu2S D.Cu2(OH)2CO3
(2)2014年我国精炼铜产量796万吨,若全部由含Cu2S质量分数为32%的铜矿石冶炼得到,则需要铜矿石质量为________万吨。(保留一位小数)
(3)可溶性铜盐常用于生产其它含铜化合物。在KOH溶液中加入一定量的CuSO4溶液,再加入一定量的还原剂——肼(N2H4),加热并保持温度在90℃,生成一种对环境无污染的气体,反应完全后,分离,洗涤,真空干燥得到纳米氧化亚铜固体(Cu2O)。
①该制备过程的反应方程式为____________________________________________。
②工业上常用的固液分离设备有________(填字母)
A.离心机 B.分馏塔 C.框式压滤机 D.反应釜
(4)我国出土的青铜器工艺精湛,具有很高的艺术价值和历史价值。但出土的青铜器大多受到环境腐蚀。右图是青铜器在潮湿环境中发生电化学腐蚀的原理示意图:

①腐蚀过程中,负极是____(填“a”“b”或“c”),正极反应方程式为_______________。
②环境中的Cl-扩散到孔口,并与正极产物和负极产物生成多孔粉状锈Cu2(OH)3Cl,其离子方程式为_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是________________________________________。
(2)装置乙,若电路中转移6.02×1022个e﹣,则C上增加的质量为 。
(3)装置丙中溶液的pH________(填“变大”“变小”或“不变”)。
(4)四种金属活动性由强到弱的顺序是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨气在生产、生活和科研中应用十分广泛。
(1)①SNCR-SCR是一种新型的烟气脱硝技术(除去烟气中的NOx),SNCR-SCR流程中发生的主要反应有:
4NO(g)+4NH3(g)+O2(g) ![]() 4N2(g)+6H2O(g)△H=-1627.2kJmol-1;
4N2(g)+6H2O(g)△H=-1627.2kJmol-1;
6NO(g)+4NH3(g) ![]() 5N2(g)+6H2O(g)△H=-1807.0kJmol-1;
5N2(g)+6H2O(g)△H=-1807.0kJmol-1;
6NO2(g)+8NH3(g) ![]() 7N2(g)+12H2O(g)△H=-2659.9kJmol-1;
7N2(g)+12H2O(g)△H=-2659.9kJmol-1;
反应N2(g)+O2(g) ![]() 2NO(g)的△H= ____________ kJmol-1
2NO(g)的△H= ____________ kJmol-1
②液氨可以发生电离:2NH3(l) ![]() NH2-+NH4+,COCl2和液氨发生“复分解”反应生成尿素,写出该反应的化学方程式____________;
NH2-+NH4+,COCl2和液氨发生“复分解”反应生成尿素,写出该反应的化学方程式____________;
(2)氨气易液化,便于储运①若在恒温恒容的容器内进行反应2NH3(g) ![]() N2(g)+3H2(g);△H=+94.4kJ/mol,下列表示该反应达到平衡状态的标志有____________(填字母序号)
N2(g)+3H2(g);△H=+94.4kJ/mol,下列表示该反应达到平衡状态的标志有____________(填字母序号)
A.容器中混合气体的密度保持不变
B.NH3(g)百分含量保持不变
C.容器中混合气体的压强保持不变
D.有3个H-H键生成同时又1个N≡N键生成
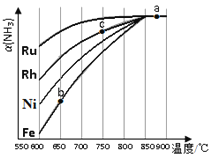
②其他条件相同时,该反应在不同催化剂作用下反应,相同时间后,氨气的转化率随反应温度的变化如图所示.在600℃时催化效果最好的是____________(填催化剂的化学式).c点氨气的转化率高于b点,原因是____________。
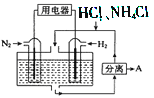
(3)如图表示使用新型电极材料,以N2、H2 为电极反应物,以HCl-NH4Cl为电解质溶液组成的既能提供能量又能实现氮固定的新型电池。请写出该电池的正极反应式____________;生产中可分离出的物质A的化学式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)下图由短周期元素形成的物质之间的转化关系,其中A、D、L为单质,其他为化合物。其中化合物I、J、K中含有两种相同的元素,G和I的反应⑤是一种重要化工生产中的主要反应之一。B常温下为液态化合物,F是一种直线型的非极性气体分子。
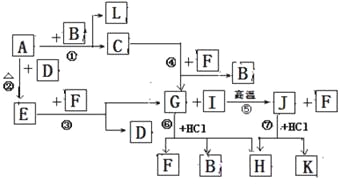
试回答下列有关问题:
(1)以上7个化学反应属于同种元素自身氧化还原反应的是 ;(用编号①→⑦填写)
(2)在G、J、H中含有相同的元素是 (填元素名称);
(3)J的水溶液和F______(填“能”或”否”)发生反应,其理由是 ;
(4)写出电解溶液H的离子反应方程式 ;
(5)反应⑤的化学方程式是 ;
(6)写出J的两种常见用途 、 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列配合物的配位数不是6的是( )
A.Na3[AlF6]
B.Na2[SiF6]
C.[Cu(NH3)4](OH)2
D.[Pt(NH3)2Cl4]Cl4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温下,Al(OH)3的Ksp或溶解度远大于Fe(OH)3。向浓度均为0.1 mol·L-1的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH溶液。下列示意图表示生成Al(OH)3的物质的量与加入NaOH溶液的体积的关系,合理的是( )
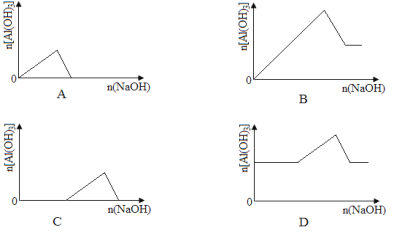
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中进行反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是( )
2SO3(g) ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是( )

A. 图Ⅰ表示温度对化学平衡的影响,且甲的温度较高
B. 图Ⅱ表示t0时刻使用催化剂对反应速率的影响
C. 图Ⅲ表示t0时刻增大O2的浓度对反应速率的影响
D. 图Ⅳ中a、b、c三点中只有b点已经达到化学平衡状态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com