
【题目】已知室温下,Al(OH)3的Ksp或溶解度远大于Fe(OH)3。向浓度均为0.1 mol·L-1的Fe(NO3)3和Al(NO3)3混合溶液中,逐滴加入NaOH溶液。下列示意图表示生成Al(OH)3的物质的量与加入NaOH溶液的体积的关系,合理的是( )
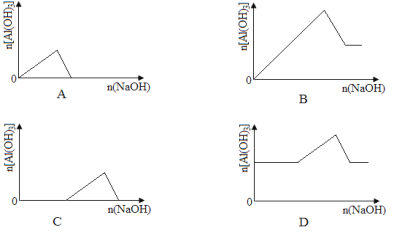
【答案】C
【解析】
试题分析:浓度均为0.1molL-1的Fe(NO3)3和Al(NO3)3混合溶液中,溶液中铁离子、铝离子的浓度相同为0.1mol/L,Al(OH)3的Ksp或溶解度远大于Fe(OH)3,故向混合溶液逐滴加入NaOH溶液,铁离子首先转化为氢氧化铁沉淀,当铁离子完全沉淀,铝离子再转化为氢氧化铝沉淀,当铝离子沉淀完全,再加入氢氧化钠,氢氧化铝溶解,沉淀的质量减少,由于氢氧化铁不溶于碱,故沉淀减少到一定值不再变化,为氢氧化铁的物质的量。A、向混合溶液逐滴加入NaOH溶液,铁离子首先转化为氢氧化铁沉淀,当铁离子完全沉淀,铝离子再转化为氢氧化铝沉淀,故开始加入氢氧化钠溶液不能立即产生氢氧化铝沉淀,图象与实际不相符,故A错误;B、向混合溶液逐滴加入NaOH溶液,铁离子首先转化为氢氧化铁沉淀,当铁离子完全沉淀,铝离子再转化为氢氧化铝沉淀,故开始加入氢氧化钠溶液不能立即产生氢氧化铝沉淀,图象与实际不相符,故B错误;C、铁离子首先转化为氢氧化铁沉淀,当铁离子完全沉淀,铝离子再转化为氢氧化铝沉淀,当铝离子沉淀完全,再加入氢氧化钠,氢氧化铝溶解,图象与实际相符合,故C正确;D、加入氢氧化钠一定体积后才会产生氢氧化铝沉淀,故D错误;故选C。


科目:高中化学 来源: 题型:
【题目】下列关于有关物质的叙述正确的是( )
①酸性氧化物肯定是非金属氧化物 ②不能跟酸反应的氧化物一定能跟碱反应 ③碱性氧化物肯定是金属氧化物 ④分散系一定是混合物 ⑤浊液均可用过滤的方法分离
A.①③ B.③④ C.②④ D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)铜、铁都是日常生活中常见的金属,它们的单质及其化合物在科学研究和工农业生产中具有广泛用途。
请回答以下问题:
(1)超细铜粉可用作导电材料、催化剂等,其制备方法如下:
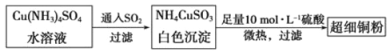
①Cu2+的价电子排布图 ;NH4CuSO3中N、O、S三种元素的第一电离能由大到小顺序为________(填元素符号)。
②SO42-的空间构型为 ,SO32-离子中心原子的杂化方式为 。
(2)请写出向Cu(NH3)4SO4水溶液中通入SO2时发生反应的离子方程式 。
(3)某学生向CuSO4溶液中加入少量氨水生成蓝色沉淀,继续加入过量氨水沉淀溶解,得到深蓝色透明溶液,最后向该溶液中加入一定量乙醇,析出[Cu(NH3)4]SO4·H2O晶体。
①下列说法正确的是
a.氨气极易溶于水,是因为NH3分子和H2O分子之间形成3种不同的氢键
b.NH3分子和H2O分子,分子空间构型不同,氨气分子的键角小于水分子的键角
c.Cu(NH3)4SO4所含有的化学键有离子键、极性共价键和配位键
d.Cu(NH3)4SO4组成元素中电负性最大的是氮元素
②请解释加入乙醇后析出晶体的原因 。
(4)Cu晶体的堆积方式如图所示,设Cu原子半径为r,晶体中Cu原子的配位数为 ,晶体的空间利用率为 (列式)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胃酸过多是常见的胃病。下面是甲、乙两种常见胃药的说明摘要。
甲:①白色结晶状粉末,可缓缓分解;
②能溶于水;
③遇酸及酸性药物则产生二氧化碳;
④胃酸患者过多服用多见胃胀气,甚至有引起胃溃疡穿孔的危险。
乙:①与胃酸作用是中和反应,作用缓慢而持久,可维持3~4小时。
②凝胶本身覆盖于溃疡面上,具有保护作用。
③可溶于稀酸或氢氧化钠溶液中。
(1)请你推测,甲中含有的主要化学成分是________(填化学式);乙中含有的主要化学成分是________(填化学式)。
(2)试写出甲中含有的主要化学成分引起胃胀气反应的离子方程式:____________________________。
(3)试写出乙中含有的主要化学成分溶于NaOH溶液的离子方程式:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
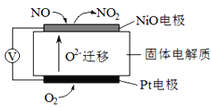
【题目】2015年9月爆发的德国大众车尾气排放作弊事件引起了公众的关注。大众车尾气中常含有大里氮氧化物.通常会采用喷射尿素溶液的方法,将有毒的氮氧化物还原成无污染的物质。大众选择了一种违规做法,即在客户平时用车时不开启喷射尿素的尾气后处理系统,而是通过软件让这一系统只在尾气排放检测时启动。
I、通过NOx传感器可监测空气的NOx的含量,其工作原理图如下图,写出NiO电极的电极反应式__________________;
Ⅱ、以CO2与NH3为原料可合成尿素[化学式为CO(NH2)2]。已知:
①2NH3(g)+CO2(g)=NH2CO2NH4(s) △H=-l59.5kJmol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) △H=+116.5kJmol-1
③H2O(l)=H2O(g) △H=+44.0kJmol-1
(1)写出CO2与NH3合成尿素和液态水的热化学反应方程式____________;
(2)恒温下将2molNH3和1molCO2放入容积为2L的密闭容器中,反应生成NH2CO2NH4(s),2分钟后达到平衡。此时NH3的浓度为0.8mol/L,则CO2的反应速率为________,NH3的转化率是________。
Ⅲ、尿素在一定温度下可分解生成NH3,NH3催化还原NxOy可以消除氮氧化物的污染。已知:
反应a:4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(l)
5N2(g)+6H2O(l)
反应b:2NO(g)+O2(g)![]() 2NO2(g)
2NO2(g)
反应c: 4NH3(g)+6NO2(g)![]() 5N2(g)+3O2(g)+6H2O(l)
5N2(g)+3O2(g)+6H2O(l)
(1)相同条件下,反应a在2L密闭容器内,选用不同的催化剂,反应产物N2的量随时间变化如图所示。下列说法正确的是________________。
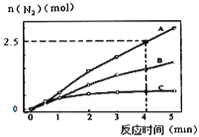
A.该反应的活化能大小顺序是:Ea(A)>Ea(B)>Ea(C)
B.增大压强能使反应速率加快,是因为增加了活化分子百分数
C.单位时间内H-O键与N-H键断裂的数目相等时,说明反应已经达到平衡
D.若在恒容绝热的密闭容器中发生反应,当K值不变时,说明反应已经达到平衡
(2)对于反应c来说,可加快反应速率的措施有_______________(任写2种)
(3)恒温恒容条件下,反应b达到平衡时体系中n(NO):n(O2):n(NO2)=2:1:2,在其他条件不变时,再充入NO2气体,NO2体积分数_______(填“变大”、“变小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可用自由电子与金属离子的碰撞中有能量传递来解释的物理性质是( )
A.金属是热的良导体
B.金属是电的良导体
C.金属有良好的延展性
D.有金属光泽,不透明
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O3)是常用的食品抗氧化剂之一,在空气中被氧化生成的产物为Na2SO4.某小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用下图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置II中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5
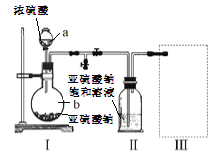
(1)仪器a、b的名称分别是_________、__________。
(2)装置I中产生气体的化学方程式为__________。
(3)要从装置II中获得已析出的晶体,可采用的分离方法是__________,该方法用到的玻璃仪器除烧杯、漏斗还需___________。
(4)装置III用于处理尾气,可选用的最合理装置(夹持仪器已略去)为_________(填序号)。
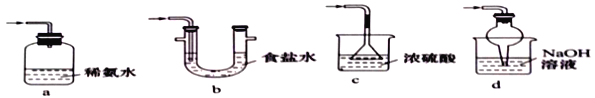
实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3
(5)NaHSO3溶液中HSO3-的电离程度大于水解程度,可采用的实验方法是_________(填序号)。
A.测定溶液的pH
B.加入Ba(OH)2溶液
C.加入盐酸
D.加入品红溶液
E.用蓝色石蕊试纸检测
(6)检验Na2S2O5晶体在空气中已被氧化的实验方案是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】厨房中的化学知识很多,下面是有关厨房中的常见操作或者常见现象,其中属于氧化还原反应的是
A. 食醋不慎洒落到大理石台面出现腐蚀现象
B. 做馒头用的发面中常加入少许碱面(小苏打)揉和
C. 烧菜用过的铁锅,经放置常出现红棕色斑迹
D. 粗盐潮解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com