
ЎҫМвДҝЎҝ2015Дк9ФВұ¬·ўөДөВ№ъҙуЦЪіөОІЖшЕЕ·ЕЧчұЧКВјюТэЖрБЛ№«ЦЪөД№ШЧўЎЈҙуЦЪіөОІЖшЦРіЈә¬УРҙуАпөӘСх»ҜОпЈ®НЁіЈ»бІЙУГЕзЙдДтЛШИЬТәөД·Ҫ·ЁЈ¬Ҫ«УР¶ҫөДөӘСх»ҜОп»№ФӯіЙОЮОЫИҫөДОпЦКЎЈҙуЦЪСЎФсБЛТ»ЦЦОҘ№жЧц·ЁЈ¬јҙФЪҝН»§ЖҪКұУГіөКұІ»ҝӘЖфЕзЙдДтЛШөДОІЖшәуҙҰАнПөНіЈ¬¶шКЗНЁ№эИнјюИГХвТ»ПөНіЦ»ФЪОІЖшЕЕ·ЕјмІвКұЖф¶ҜЎЈ
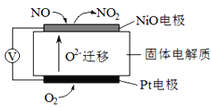
IЎўНЁ№эNOxҙ«ёРЖчҝЙјаІвҝХЖшөДNOxөДә¬БҝЈ¬Жд№ӨЧчФӯАнНјИзПВНјЈ¬РҙіцNiOөзј«өДөзј«·ҙУҰКҪ__________________Ј»
ўтЎўТФCO2УлNH3ОӘФӯБПҝЙәПіЙДтЛШ[»ҜС§КҪОӘCO(NH2)2]ЎЈТСЦӘЈә
ўЩ2NH3(g)+CO2(g)=NH2CO2NH4(s) ЎчH=-l59.5kJmol-1
ўЪNH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ЎчH=+116.5kJmol-1
ўЫH2O(l)=H2O(g) ЎчH=+44.0kJmol-1
ЈЁ1Ј©РҙіцCO2УлNH3әПіЙДтЛШәНТәМ¬Л®өДИИ»ҜС§·ҙУҰ·ҪіМКҪ____________Ј»
ЈЁ2Ј©әгОВПВҪ«2molNH3әН1molCO2·ЕИлИЭ»эОӘ2LөДГЬұХИЭЖчЦРЈ¬·ҙУҰЙъіЙNH2CO2NH4(s)Ј¬2·ЦЦУәуҙпөҪЖҪәвЎЈҙЛКұNH3өДЕЁ¶ИОӘ0.8mol/LЈ¬ФтCO2өД·ҙУҰЛЩВКОӘ________Ј¬NH3өДЧӘ»ҜВККЗ________ЎЈ
ўуЎўДтЛШФЪТ»¶ЁОВ¶ИПВҝЙ·ЦҪвЙъіЙNH3Ј¬NH3ҙЯ»Ҝ»№ФӯNxOyҝЙТФПыіэөӘСх»ҜОпөДОЫИҫЎЈТСЦӘЈә
·ҙУҰaЈә4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(l)
5N2(g)+6H2O(l)
·ҙУҰbЈә2NO(g)+O2(g)![]() 2NO2(g)
2NO2(g)
·ҙУҰc: 4NH3(g)+6NO2(g)![]() 5N2(g)+3O2(g)+6H2O(l)
5N2(g)+3O2(g)+6H2O(l)
ЈЁ1Ј©ПаН¬МхјюПВЈ¬·ҙУҰaФЪ2LГЬұХИЭЖчДЪЈ¬СЎУГІ»Н¬өДҙЯ»ҜјБЈ¬·ҙУҰІъОпN2өДБҝЛжКұјдұд»ҜИзНјЛщКҫЎЈПВБРЛө·ЁХэИ·өДКЗ________________ЎЈ
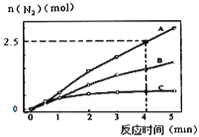
AЈ®ёГ·ҙУҰөД»о»ҜДЬҙуРЎЛіРтКЗЈәEa(A)ЈҫEa(B)ЈҫEa(C)
BЈ®ФцҙуС№ЗҝДЬК№·ҙУҰЛЩВКјУҝмЈ¬КЗТтОӘФцјУБЛ»о»Ҝ·ЦЧУ°Щ·ЦКэ
CЈ®өҘО»КұјдДЪH-OјьУлN-Hјь¶ПБСөДКэДҝПаөИКұЈ¬ЛөГч·ҙУҰТСҫӯҙпөҪЖҪәв
DЈ®ИфФЪәгИЭҫшИИөДГЬұХИЭЖчЦР·ўЙъ·ҙУҰЈ¬өұKЦөІ»ұдКұЈ¬ЛөГч·ҙУҰТСҫӯҙпөҪЖҪәв
ЈЁ2Ј©¶ФУЪ·ҙУҰcАҙЛөЈ¬ҝЙјУҝм·ҙУҰЛЩВКөДҙлК©УР_______________(ИОРҙ2ЦЦ)
ЈЁ3Ј©әгОВәгИЭМхјюПВЈ¬·ҙУҰbҙпөҪЖҪәвКұМеПөЦРn(NO):n(O2):n(NO2)=2:1:2,ФЪЖдЛыМхјюІ»ұдКұЈ¬ФЩідИлNO2ЖшМеЈ¬NO2Ме»э·ЦКэ_______(МоЎ°ұдҙуЎұЎўЎ°ұдРЎЎұ»тЎ°І»ұдЎұ)ЎЈ
Ўҫҙр°ёЎҝIЎўNO-2e- +O2-=NO2Ј»
IIЎўЈЁ1Ј©2NH3(g)+CO2(g)=CO(NH2)2(s)++H2O(l) ҰӨH=87.0kJ/molЈ»ЈЁ2Ј©0.05mol/(LЎӨmin)Ј»20%Ј»
IIIЎўЈЁ1Ј©CDЈ»ЈЁ2Ј©ФцјУNH3»тNO2»тN2»тO2өДЕЁ¶ИЈ»ЙэёЯОВ¶ИЈ»ФцҙуС№ЗҝөИЈ»ЈЁ3Ј©ұдҙуЎЈ
ЎҫҪвОцЎҝ
КФМв·ЦОцЈәIЎўЧ°ЦГОЮНвҪУөзФҙЈ¬№КОӘФӯөзіШЈ¬І¬өзј«ЙПСхЖшөГөзЧУЙъіЙСхАлЧУ¶шұ»»№ФӯЈ¬ЛщТФОӘХэј«Ј¬·ўЙъ»№Фӯ·ҙУҰЈ»NiOөзј«ЙПNOК§өзЧУәНСхАлЧУ·ҙУҰЙъіЙ¶юСх»ҜөӘЈ¬NiOОӘёәј«Ј¬ЛщТФөзј«·ҙУҰКҪОӘЈәNO+O2--2e-=NO2Ј¬№Кҙр°ёОӘЈәNO+O2--2e-=NO2Ј®
IIЎўЈЁ1Ј©ўЩ2NH3(g)+CO2(g)ЎъNH2CO2 NH4(s)+l59.5kJmol-1Ј¬ўЪNH2CO2NH4(s)ЎъCO(NH2)2(s)+H2O(g)-116.5kJmol-1Ј¬ўЫH2O(l)ЎъH2O(g)-44.0kJmol-1Ј¬ТАҫЭИИ»ҜС§·ҪіМКҪәНёЗЛ№¶ЁВЙјЖЛгўЩ+ўЪ-ўЫөГөҪCO2УлNH3әПіЙДтЛШәНТәМ¬Л®өДИИ»ҜС§·ҙУҰ·ҪіМКҪОӘЈә2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)ЎчH=-87.0KJ/molЈ»№Кҙр°ёОӘЈә2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(l)ЎчH=-87.0KJ/molЈ»
ЈЁ2Ј©ЖҪәвКұЈ¬NH3өДЕЁ¶ИОӘ0.8mol/LЈ¬ФтNH3өДОпЦКөДБҝОӘ0.8mol/LЎБ2L=1.6molЈ¬
2NH3(g)+CO2(g)![]() NH2CO2 NH4(s)
NH2CO2 NH4(s)
ЖрКј(mol) 2 1 0
·ҙУҰ 0.4 0.2 0.2
ЖҪәв 1.6 0.8
CO2өД·ҙУҰЛЩВК=![]() =
= =0.05mol/(LЎӨmin)Ј¬NH3өДЧӘ»ҜВК=
=0.05mol/(LЎӨmin)Ј¬NH3өДЧӘ»ҜВК=![]() ЎБ100%=20%Ј¬№Кҙр°ёОӘЈә0.05mol/(LЎӨmin)Ј»20%Ј»
ЎБ100%=20%Ј¬№Кҙр°ёОӘЈә0.05mol/(LЎӨmin)Ј»20%Ј»
IIIЎўЈЁ1Ј©AЈ®ПаН¬КұјдДЪЙъіЙөДөӘЖшөДОпЦКөДБҝФҪ¶аЈ¬Фт·ҙУҰЛЩВКФҪҝмЈ¬»о»ҜДЬФҪөНЈ¬ЛщТФёГ·ҙУҰөД»о»ҜДЬҙуРЎЛіРтКЗЈәEa(A)ЈјEa(B)ЈјEa(C)Ј¬№КAҙнОуЈ»BЈ®ФцҙуС№ЗҝДЬК№·ҙУҰЛЩВКјУҝмЈ¬КЗТтОӘФцҙуБЛ»о»Ҝ·ЦЧУКэЈ¬¶ш»о»Ҝ·ЦЧУ°Щ·ЦКэІ»ұдЈ¬№КBҙнОуЈ»CЈ®өҘО»КұјдДЪH-Oјь¶ПБСұнКҫДжЛЩВКЈ¬N-Hјь¶ПБСұнКҫХэЛЩВКЈ¬өҘО»КұјдДЪH-OјьУлN-Hјь¶ПБСөДКэДҝПаөИКұЈ¬ФтПыәДөДNH3әНПыәДөДЛ®өДОпЦКөДБҝЦ®ұИОӘ4Јә6Ј¬ФтХэДжЛЩВКЦ®ұИөИУЪ4Јә6Ј¬ЛөГч·ҙУҰТСҫӯҙпөҪЖҪәвЈ¬№КCХэИ·Ј»DЈ®ёГ·ҙУҰОӘ·ЕИИ·ҙУҰЈ¬әгИЭҫшИИөДГЬұХИЭЖчЦРЈ¬·ҙУҰКұОВ¶И»бЙэёЯЈ¬ФтK»бјхРЎЈ¬өұKЦөІ»ұдКұЈ¬ЛөГч·ҙУҰТСҫӯҙпөҪЖҪәвЈ¬№КDХэИ·Ј»№Кҙр°ёОӘЈәCDЈ»
ЈЁ2Ј©¶ФУЪ·ҙУҰcАҙЛөЈ¬ҝЙјУҝм·ҙУҰЛЩВКөДҙлК©УРФцјУNH3»тNO2»тN2»тO2өДЕЁ¶ИЈ»ЙэёЯОВ¶ИЈ»ФцҙуС№ЗҝөИЈ¬№Кҙр°ёОӘЈәФцјУNH3»тNO2»тN2»тO2өДЕЁ¶ИЈ»ЙэёЯОВ¶ИЈ»ФцҙуС№ЗҝөИЈ»
ЈЁ3Ј©Т»¶ЁМхјюПВЈ¬·ҙУҰII2NO(g)+O2(g)![]() 2NO2(g)ҙпөҪЖҪәвКұМеПөЦРn(NO)Јәn(O2)Јәn(NO2)=2Јә1Јә2ЎЈФЪЖдЛьМхјюІ»ұдКұЈ¬ИфәгОВәгИЭИЭЖчЦРЈ¬ФЩідИлNO2ЖшМеЈ¬ИЭЖчЦРС№ЗҝФцҙуЈ¬УлФӯАҙЖҪәвПаұИҪПЈ¬ЖҪәвХэПтТЖ¶ҜЈ¬ФтNO2Ме»э·ЦКэұдҙуЈ»№Кҙр°ёОӘЈәұдҙуЎЈ
2NO2(g)ҙпөҪЖҪәвКұМеПөЦРn(NO)Јәn(O2)Јәn(NO2)=2Јә1Јә2ЎЈФЪЖдЛьМхјюІ»ұдКұЈ¬ИфәгОВәгИЭИЭЖчЦРЈ¬ФЩідИлNO2ЖшМеЈ¬ИЭЖчЦРС№ЗҝФцҙуЈ¬УлФӯАҙЖҪәвПаұИҪПЈ¬ЖҪәвХэПтТЖ¶ҜЈ¬ФтNO2Ме»э·ЦКэұдҙуЈ»№Кҙр°ёОӘЈәұдҙуЎЈ



| Дкј¶ | ёЯЦРҝОіМ | Дкј¶ | іхЦРҝОіМ |
| ёЯТ» | ёЯТ»Гв·СҝОіМНЖјцЈЎ | іхТ» | іхТ»Гв·СҝОіМНЖјцЈЎ |
| ёЯ¶ю | ёЯ¶юГв·СҝОіМНЖјцЈЎ | іх¶ю | іх¶юГв·СҝОіМНЖјцЈЎ |
| ёЯИэ | ёЯИэГв·СҝОіМНЖјцЈЎ | іхИэ | іхИэГв·СҝОіМНЖјцЈЎ |
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝТФПВ·ЗҪрКфСх»ҜОпУлЖдТэЖрөД»·ҫіОКМвј°ЦчТӘАҙФҙ¶ФУҰХэИ·өДКЗ ЈЁ Ј©
Сх»ҜОп | »·ҫіОКМв | ЦчТӘАҙФҙ | |
A | CO2 | ЛбУк | »ҜКҜИјБПөДИјЙХ |
B | SO2 | №в»ҜС§СМОн | ЖыіөОІЖшөДЕЕ·Е |
C | NO2 | ОВКТР§УҰ | №Өі§·ПЖшөДЕЕ·Е |
D | CO | COЦР¶ҫ | ИјБПөДІ»НкИ«ИјЙХ |
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝ°ұЖшФЪЙъІъЎўЙъ»оәНҝЖСРЦРУҰУГК®·Ц№г·әЎЈ
ЈЁ1Ј©ўЩSNCR-SCRКЗТ»ЦЦРВРНөДСМЖшНСПхјјКхЈЁіэИҘСМЖшЦРөДNOxЈ©Ј¬SNCR-SCRБчіМЦР·ўЙъөДЦчТӘ·ҙУҰУРЈә
4NOЈЁgЈ©+4NH3ЈЁgЈ©+O2ЈЁgЈ© ![]() 4N2ЈЁgЈ©+6H2OЈЁgЈ©ЎчH=-1627Ј®2kJmol-1Ј»
4N2ЈЁgЈ©+6H2OЈЁgЈ©ЎчH=-1627Ј®2kJmol-1Ј»
6NOЈЁgЈ©+4NH3ЈЁgЈ© ![]() 5N2ЈЁgЈ©+6H2OЈЁgЈ©ЎчH=-1807Ј®0kJmol-1Ј»
5N2ЈЁgЈ©+6H2OЈЁgЈ©ЎчH=-1807Ј®0kJmol-1Ј»
6NO2ЈЁgЈ©+8NH3ЈЁgЈ© ![]() 7N2ЈЁgЈ©+12H2OЈЁgЈ©ЎчH=-2659Ј®9kJmol-1Ј»
7N2ЈЁgЈ©+12H2OЈЁgЈ©ЎчH=-2659Ј®9kJmol-1Ј»
·ҙУҰN2ЈЁgЈ©+O2ЈЁgЈ© ![]() 2NOЈЁgЈ©өДЎчH= ____________ kJmol-1
2NOЈЁgЈ©өДЎчH= ____________ kJmol-1
ўЪТә°ұҝЙТФ·ўЙъөзАлЈә2NH3ЈЁlЈ© ![]() NH2-+NH4+Ј¬COCl2әНТә°ұ·ўЙъЎ°ёҙ·ЦҪвЎұ·ҙУҰЙъіЙДтЛШЈ¬РҙіцёГ·ҙУҰөД»ҜС§·ҪіМКҪ____________Ј»
NH2-+NH4+Ј¬COCl2әНТә°ұ·ўЙъЎ°ёҙ·ЦҪвЎұ·ҙУҰЙъіЙДтЛШЈ¬РҙіцёГ·ҙУҰөД»ҜС§·ҪіМКҪ____________Ј»
ЈЁ2Ј©°ұЖшТЧТә»ҜЈ¬ұгУЪҙўФЛўЩИфФЪәгОВәгИЭөДИЭЖчДЪҪшРР·ҙУҰ2NH3ЈЁgЈ© ![]() N2ЈЁgЈ©+3H2ЈЁgЈ©Ј»ЎчH=+94Ј®4kJ/molЈ¬ПВБРұнКҫёГ·ҙУҰҙпөҪЖҪәвЧҙМ¬өДұкЦҫУР____________ЈЁМоЧЦДёРтәЕЈ©
N2ЈЁgЈ©+3H2ЈЁgЈ©Ј»ЎчH=+94Ј®4kJ/molЈ¬ПВБРұнКҫёГ·ҙУҰҙпөҪЖҪәвЧҙМ¬өДұкЦҫУР____________ЈЁМоЧЦДёРтәЕЈ©
AЈ®ИЭЖчЦР»мәПЖшМеөДГЬ¶ИұЈіЦІ»ұд
BЈ®NH3ЈЁgЈ©°Щ·Цә¬БҝұЈіЦІ»ұд
CЈ®ИЭЖчЦР»мәПЖшМеөДС№ЗҝұЈіЦІ»ұд
DЈ®УР3ёцH-HјьЙъіЙН¬КұУЦ1ёцNЎФNјьЙъіЙ
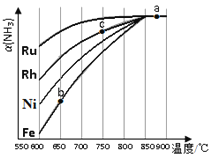
ўЪЖдЛыМхјюПаН¬КұЈ¬ёГ·ҙУҰФЪІ»Н¬ҙЯ»ҜјБЧчУГПВ·ҙУҰЈ¬ПаН¬КұјдәуЈ¬°ұЖшөДЧӘ»ҜВКЛж·ҙУҰОВ¶ИөДұд»ҜИзНјЛщКҫЈ®ФЪ600ЎжКұҙЯ»ҜР§№ыЧоәГөДКЗ____________ЈЁМоҙЯ»ҜјБөД»ҜС§КҪЈ©Ј®cөг°ұЖшөДЧӘ»ҜВКёЯУЪbөгЈ¬ФӯТтКЗ____________ЎЈ
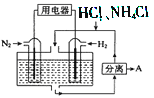
ЈЁ3Ј©ИзНјұнКҫК№УГРВРНөзј«ІДБПЈ¬ТФN2ЎўH2 ОӘөзј«·ҙУҰОпЈ¬ТФHCl-NH4ClОӘөзҪвЦКИЬТәЧйіЙөДјИДЬМṩДЬБҝУЦДЬКөПЦөӘ№М¶ЁөДРВРНөзіШЎЈЗлРҙіцёГөзіШөДХэј«·ҙУҰКҪ____________Ј»ЙъІъЦРҝЙ·ЦАліцөДОпЦКAөД»ҜС§КҪОӘ____________ЎЈ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝПВБРЕдәПОпөДЕдО»КэІ»КЗ6өДКЗ( Ј©
AЈ®Na3[AlF6]
BЈ®Na2[SiF6]
CЈ®[Cu(NH3Ј©4](OHЈ©2
DЈ®[Pt(NH3Ј©2Cl4]Cl4
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝТСЦӘКТОВПВЈ¬Al(OH)3өДKsp»тИЬҪв¶ИФ¶ҙуУЪFe(OH)3ЎЈПтЕЁ¶ИҫщОӘ0.1 molЎӨL-1өДFe(NO3)3әНAl(NO3)3»мәПИЬТәЦРЈ¬ЦрөОјУИлNaOHИЬТәЎЈПВБРКҫТвНјұнКҫЙъіЙAl(OH)3өДОпЦКөДБҝУлјУИлNaOHИЬТәөДМе»эөД№ШПөЈ¬әПАнөДКЗ( )
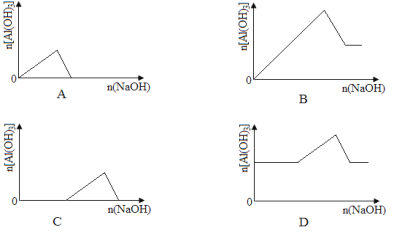
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝТСЦӘXОӘТ»ЦЦіЈјыЛбөДЕЁИЬТәЈ¬ДЬК№ХбМЗұдәЪЎЈAУлX·ҙУҰөДЧӘ»Ҝ№ШПөИзНјЛщКҫЈ¬ЖдЦР·ҙУҰМхјюј°Іҝ·ЦІъОпҫщТСВФИҘЈ¬ФтПВБРУР№ШЛө·ЁХэИ·өДКЗ

AЈ®ИфAОӘМјөҘЦКЈ¬ФтҪ«CНЁИлЙЩБҝөДіОЗеКҜ»ТЛ®ЦРЈ¬Т»¶ЁҝЙТФ№ЫІмөҪ°ЧЙ«іБөнІъЙъ
BЈ®ИфAОӘМъЈ¬ФтЧгБҝAУлXФЪКТОВПВјҙҝЙНкИ«·ҙУҰ
C Ј®XК№ХбМЗұдәЪөДПЦПуЦчТӘМеПЦБЛXөДНСЛ®РФ
DЈ®№ӨТөЙПЈ¬BЧӘ»ҜОӘDөД·ҙУҰМхјюОӘёЯОВЎўіЈС№ЎўК№УГҙЯ»ҜјБ
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝјИДЬК№КҜИпКФТәұдәмЈ¬УЦДЬК№Ж·әмКФТәұдОӘОЮЙ«өДОпЦККЗЈЁ Ј©
AЈ®NH3 BЈ®HCl CЈ®SO2 DЈ®CO2
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝТСЦӘAЎўBЎўCЎўDЎўEЎўF¶јКЗЦЬЖЪұнЦРЗ°ЛДЦЬЖЪөДФӘЛШЈ¬ЛьГЗөДәЛөзәЙКэТАҙОФцҙуЎЈЖдЦР»щМ¬AФӯЧУјЫөзЧУЕЕІјКҪОӘnsnnpn+1Ј»»ҜәПОпB2EОӘАлЧУ»ҜәПОпЈ¬EФӯЧУәЛНвөДMІгЦРЦ»УРБҪ¶ФіЙ¶ФөзЧУЈ»CФӘЛШКЗөШҝЗЦРә¬БҝЧоёЯөДҪрКфФӘЛШЈ»DөҘЦКіЈУГУЪЦЖЧчМ«СфДЬөзіШәНјҜіЙөзВ·РҫЖ¬Ј»FФӯЧУЧоНвІгөзЧУКэУлBөДПаН¬Ј¬ЖдУаёчДЪІг№мөАҫщідВъөзЧУЎЈЗлёщҫЭТФЙПРЕПўЈ¬»ШҙрПВБРОКМвЈЁУГЛщ¶ФУҰөДФӘЛШ·ыәЕұнКҫЈ©Јә
ЈЁ1Ј©AЎўBЎўEөДөЪТ»өзАлДЬУЙРЎөҪҙуөДЛіРтОӘ ЎЈ
ЈЁ2Ј©Зв»ҜОпA2H4·ЦЧУЦРAФӯЧУІЙИЎ ФУ»ҜЎЈ
ЈЁ3Ј©°ҙФӯЧУөДНвО§өзЧУЕЕІј·ЦЗшЈ¬ФӘЛШFФЪ ЗшЈ¬»щМ¬FФӯЧУөДөзЧУЕЕІјКҪОӘ ЎЈ
ЈЁ4Ј©ФӘЛШAәНCҝЙРОіЙТ»ЦЦРВРН»ҜәПОпІДБПЈ¬Ждҫ§МеҫЯУРәЬёЯөДУІ¶ИәНИЫөгЈ¬Жд»ҜәПОпЦРЛщә¬өД»ҜС§јьАаРНОӘ ЎЈ
ЈЁ5Ј©AЎўFРОіЙДіЦЦ»ҜәПОпөДҫ§°ыҪб№№ИзПВНјЛщКҫЈЁЖдЦРAПФ©Ғ3јЫЈ¬ГҝёцЗтҫщұнКҫ1ёцФӯЧУЈ©Ј¬ФтЖд»ҜС§КҪОӘ ЎЈЙи°ў·ьјУөВВЮіЈКэОӘNAЈ¬ҫаАлЧоҪьөДБҪёцFФӯЧУөДәЛјдҫаОӘa cmЈ¬ФтёГҫ§°ыөДГЬ¶ИОӘЈЁУГә¬aәНNAөДҙъКэКҪұнКҫЈ© g/cm3ЎЈ
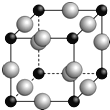
Ійҝҙҙр°ёәНҪвОц>>
ҝЖДҝЈәёЯЦР»ҜС§ АҙФҙЈә МвРНЈә
ЎҫМвДҝЎҝRFCКЗТ»ЦЦҪ«Л®өзҪвјјКхУлЗвСхИјБПөзіШјјКхПаҪбәПөДҝЙідөзөзіШЎЈУТНјОӘRFC№ӨЧчФӯАнКҫТвНјЈ¬ПВБРУР№ШЛө·ЁХэИ·өДКЗ
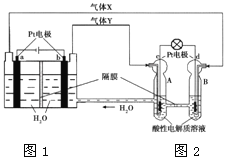
A. Нј1°С»ҜС§ДЬЧӘ»ҜОӘөзДЬЈ¬Нј2°СөзДЬЧӘ»ҜОӘ»ҜС§ДЬЈ¬Л®өГөҪБЛСӯ»·К№УГ
B. өұУР0.1 molөзЧУЧӘТЖКұЈ¬aј«ІъЙъ0.56 L O2ЈЁұкЧјЧҙҝцПВЈ©
C. cј«ЙП·ўЙъөДөзј«·ҙУҰКЗЈәO2+ 4H++ 4e-= 2H2O
D. Нј2ЦРөзЧУҙУcј«БчПтdј«Ј¬МṩөзДЬ
Ійҝҙҙр°ёәНҪвОц>>
№ъјКѧУУЕСЎ - Б·П°ІбБРұн - КФМвБРұн
әюұұКЎ»ҘБӘНшОҘ·ЁәНІ»БјРЕПўҫЩұЁЖҪМЁ | НшЙПУРәҰРЕПўҫЩұЁЧЁЗш | өзРЕХ©ЖӯҫЩұЁЧЁЗш | ЙжАъК·РйОЮЦчТеУРәҰРЕПўҫЩұЁЧЁЗш | ЙжЖуЗЦИЁҫЩұЁЧЁЗш
ОҘ·ЁәНІ»БјРЕПўҫЩұЁөз»°Јә027-86699610 ҫЩұЁУКПдЈә58377363@163.com