
����Ŀ��RFC��һ�ֽ�ˮ��⼼��������ȼ�ϵ�ؼ������ϵĿɳ���ء���ͼΪRFC����ԭ��ʾ��ͼ�������й�˵����ȷ����
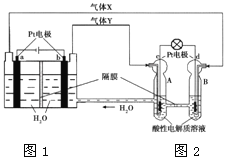
A. ͼ1�ѻ�ѧ��ת��Ϊ���ܣ�ͼ2�ѵ���ת��Ϊ��ѧ�ܣ�ˮ�õ���ѭ��ʹ��
B. ����0.1 mol����ת��ʱ��a������0.56 L O2����״���£�
C. c���Ϸ����ĵ缫��Ӧ�ǣ�O2+ 4H++ 4e-= 2H2O
D. ͼ2�е��Ӵ�c������d�����ṩ����
���𰸡�C
����������������������еĵ缫��ӦΪ��b�缫Ϊ����ʧ���ӷ���������Ӧ��4OH--4e-=2H2O+O2����a�缫Ϊ�����õ����ӷ�����ԭ��Ӧ��4H++4e-=2H2����ԭ�������������Һ���缫��ӦΪ��dΪ����ʧ���ӷ���������Ӧ��2H2-4e-=4H+��c�缫Ϊ�����õ����ӷ�����ԭ��Ӧ��O2+4H++4e-=2H2O��A��ͼ1�ǵ����ǵ���ת��Ϊ��ѧ�ܣ�ͼ2��ԭ���Ϊ��ѧ��ת��Ϊ���ܣ���A����B������0.1 mol����ת��ʱ��a�缫Ϊ�����������缫��ӦΪ4H++4e-=2H2����������O2����B����C��C�缫Ϊ�����õ����ӷ�����ԭ��Ӧ��O2+4H++4e-=2H2O����C��ȷ��D��ͼ2��cΪ������d��Ϊ���������Ӵ�d������c�����ṩ���ܣ���D����ѡC��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2015��9�±����ĵ¹����ڳ�β���ŷ������¼������˹��ڵĹ�ע�����ڳ�β���г����д��ﵪ�����ͨ�����������������Һ�ķ��������ж��ĵ������ﻹԭ������Ⱦ�����ʡ�����ѡ����һ��Υ�����������ڿͻ�ƽʱ�ó�ʱ�������������ص�β������ϵͳ������ͨ����������һϵͳֻ��β���ŷż��ʱ������
I��ͨ��NOx�������ɼ�������NOx�ĺ������乤��ԭ��ͼ����ͼ��д��NiO�缫�ĵ缫��Ӧʽ__________________��
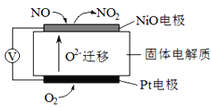
������CO2��NH3Ϊԭ�Ͽɺϳ�����[��ѧʽΪCO(NH2)2]����֪��
��2NH3(g)+CO2(g)=NH2CO2NH4(s) ��H=-l59.5kJmol-1
��NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) ��H=+116.5kJmol-1
��H2O(l)=H2O(g) ��H=+44.0kJmol-1
��1��д��CO2��NH3�ϳ����غ�Һ̬ˮ���Ȼ�ѧ��Ӧ����ʽ____________��
��2�������½�2molNH3��1molCO2�����ݻ�Ϊ2L���ܱ������У���Ӧ����NH2CO2NH4(s)��2���Ӻ�ﵽƽ�⡣��ʱNH3��Ũ��Ϊ0.8mol/L����CO2�ķ�Ӧ����Ϊ________��NH3��ת������________��
����������һ���¶��¿ɷֽ�����NH3��NH3����ԭNxOy�������������������Ⱦ����֪��
��Ӧa��4NH3(g)+6NO(g)![]() 5N2(g)+6H2O(l)
5N2(g)+6H2O(l)
��Ӧb��2NO(g)+O2(g)![]() 2NO2(g)
2NO2(g)
��Ӧc: 4NH3(g)+6NO2(g)![]() 5N2(g)+3O2(g)+6H2O(l)
5N2(g)+3O2(g)+6H2O(l)
��1����ͬ�����£���Ӧa��2L�ܱ������ڣ�ѡ�ò�ͬ�Ĵ�������Ӧ����N2������ʱ��仯��ͼ��ʾ������˵����ȷ����________________��
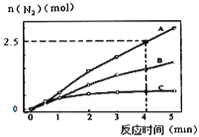
A���÷�Ӧ�Ļ�ܴ�С˳���ǣ�Ea(A)��Ea(B)��Ea(C)
B������ѹǿ��ʹ��Ӧ���ʼӿ죬����Ϊ�����˻���Ӱٷ���
C����λʱ����H-O����N-H�����ѵ���Ŀ���ʱ��˵����Ӧ�Ѿ��ﵽƽ��
D�����ں��ݾ��ȵ��ܱ������з�����Ӧ����Kֵ����ʱ��˵����Ӧ�Ѿ��ﵽƽ��
��2�����ڷ�Ӧc��˵���ɼӿ췴Ӧ���ʵĴ�ʩ��_______________(��д2��)
��3�����º��������£���Ӧb�ﵽƽ��ʱ��ϵ��n(NO):n(O2):n(NO2)=2:1:2,��������������ʱ���ٳ���NO2���壬NO2�������_______(���������������С������������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�� I����ҵ����ϴ���ķ�ͭм��ԭ�����Ʊ�����ͭ��Ϊ�˽�Լԭ�Ϻͷ�ֹ��Ⱦ�������˲�ȡ�ķ����� ������ţ�
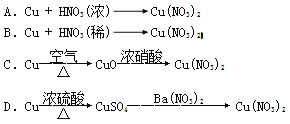
����ͼ����������ͭ��40mLϡ������100mL��ƿ�з�Ӧ��ȡһ�����������ʵ��װ��ͼ����ش��������⣺
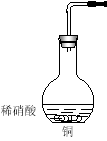

��1�������ҿ��л��������ռ�װ�õ�װ��ͼ��
��2���ٴ���ƿ��ȡ��������Ӧ�����Һ������������ˮ��д���÷�Ӧ�����ӷ���ʽ�� _______________
�ڷ�Ӧ�������ܷ��ȡ����ƿ���ټ���ϡ�����ķ�ʽ���ٻ��һ���������壿������ԣ���д����Ӧ�����ӷ���ʽ����������ԣ���˵�����ɣ�_________________________________
��3�������ͼװ�������ԵIJ����ǣ� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ԭ�Ӻ��е���������������ΪijЩ�ض���ֵʱ��ԭ�Ӻ˾��쳣�ȶ�����ѧ�ҽ���Щ��ֵ��Ϊ������������ѧ���������ͬλ��1442Si�з����µ�����ѧ���������������й�1442Si��˵����ȷ����
A. ԭ��������42 B. ��������14 C. ��������42 D. ��������14
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������еĻ�ѧ֪ʶ�ܶ࣬�������йس����еij����������߳���������������������ԭ��Ӧ����
A. ʳ�ײ������䵽����ʯ̨����ָ�ʴ����
B. ����ͷ�õķ����г������������棨С�մ����
C. �ղ��ù��������������ó����ֺ���ɫ��
D. �����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ƽ����ϵA��B![]() C��D������ѹǿʱ��Ӧ���ʱ仯��ͼ��ʾ�������й��ڸ�����״̬��˵����ȷ���ǣ� ��
C��D������ѹǿʱ��Ӧ���ʱ仯��ͼ��ʾ�������й��ڸ�����״̬��˵����ȷ���ǣ� ��

A��A��B��C��D��������
B��C��D�������壬A��B����һ��������
C��A��B���������壬C��D����һ��������
D��A��B�������壬C��D����һ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�����ת����ϵ��ͼ��ʾ������BΪ����ɫ��C����ʱΪ��ɫҺ������Է�������D��B��17��E��ԭ������Ϊ12��
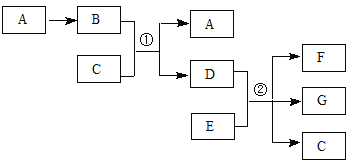
�ش��������⣺
��1��A�Ļ�ѧʽ�� ��C���ӵĵ���ʽ�� ��
��2����Ӧ�������ӷ���ʽ�� ����n��E)��n��D)=2��5����Ӧ�ڵĻ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͼ��ʾ��ת����ϵ���ҵ�X��Y��Z�����ʵ������ʱ�������ʱ䦤H����H1����H2����������������X��Y�������� ��

��C��CO ��S��SO2 ��Na��Na2O ��AlCl3��Al��OH��3��Fe��Fe��NO3��2 ��NaOH��Na2CO3
A���٢ܢ� B���٢ڢ�
C���٢ۢ� D���٢ۢܢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1���������ƳɵĽ���ȼ�ϡ��ǽ�������ȼ�ϡ���������Ӧ�õ��������߿Ƽ�����λ������A��B����ȼ��ʱ���ų������ȣ�������ȼ�ϡ���֪A��BΪ������Ԫ�أ���ԭ�ӵĵ�һ�����ĵ��������±���ʾ��

��ijͬѧ����������Ϣ���ƶ�B�ĺ�������Ų�����ͼ��ʾ����ͬѧ�����ĵ����Ų�ͼΥ�� ��BԪ��λ�����ڱ���������е� ��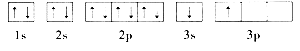
��ACl2������A���ӻ�����Ϊ ��ACl2�Ŀռ乹��Ϊ ��
��2��Feԭ�ӻ�������Χ�н϶���������Ŀչ������һЩ���ӻ������γ�����
�������������ѻ��γɵĽ������У���ԭ�ӵ���λ��Ϊ ��
��д��һ����![]() ��Ϊ�ȵ�����ĵ���������ʽ ��
��Ϊ�ȵ�����ĵ���������ʽ ��
���������������![]() ����� ��
����� ��
A�����ۼ�
B���Ǽ��Լ�
C�����
D���Ҽ�
E���м�
��3��һ��Al��Fe�Ͻ�����徧������ͼ��ʾ����ݴ˻ش��������⣺
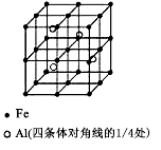
��ȷ���úϽ�Ļ�ѧʽ ��
����������ܶȣ��� g/cm3����˺Ͻ������������Feԭ��֮��ľ���(�ú��ѵĴ���ʽ��ʾ�����ػ���)Ϊ cm��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com