
【题目】(1)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。单位质量的A和B单质燃烧时均放出大量热,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:

①某同学根据上述信息,推断B的核外电子排布如下图所示,该同学所画的电子排布图违背 ,B元素位于周期表五个区域中的 区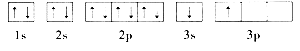
②ACl2分子中A的杂化类型为 ,ACl2的空间构型为 。
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物。
①以体心立方堆积形成的金属铁中,其原子的配位数为 。
②写出一种与![]() 互为等电子体的单质的电子式 。
互为等电子体的单质的电子式 。
③六氰合亚铁离子![]() 中不存在 。
中不存在 。
A.共价键
B.非极性键
C.配位键
D.σ键
E.π键
(3)一种Al-Fe合金的立体晶胞如下图所示。请据此回答下列问题:
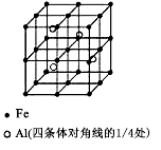
①确定该合金的化学式 。
②若晶体的密度=ρ g/cm3,则此合金中最近的两个Fe原子之间的距离(用含ρ的代数式表示,不必化简)为 cm。
【答案】(1) ①能量最低原理 (2分);s (1分)②sp杂化 (1分);直线形 (1分)
(2) ①8 (1分)②![]() (2分)③B (2分)
(2分)③B (2分)
(3) ①Fe2Al (2分) ②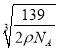 (3分)
(3分)
【解析】
试题分析:(1)①根据能量最低原理,电子总是优先占据能量低的轨道,而该同学所画的电子排布图中3s轨道未排满就去排布3p轨道,所以违背了能量最低原理;根据B的电离能的数据可知,B元素是+2价金属,所以属于第二主族元素,位于元素周期表的s区,为Mg元素;
②根据表中数据可知A也是第二主族元素,因为A、B都是短周期元素,B是Mg,则A只能是Be元素,在BeCl2中,Be的价层电子对数是![]() ,所以Be原子是sp杂化;分子为直线型分子;
,所以Be原子是sp杂化;分子为直线型分子;
(2)①以体心立方堆积形成的金属铁中,其原子的配位数为8;
②CN—中含有2个原子、10个价电子,所以与其互为等电子体的单质中含有2个原子、10个价电子,该分子式是N2,电子式为![]() ;
;
③六氰合亚铁离子[Fe(CN)6]4—中,C与N原子之间是极性共价三键,所以存在σ键 和π键,CN与Fe原子之间是配位键,但不存在非极性键,所以答案选B;
(3)①根据均摊法,该晶胞中Fe原子的个数是8×1/8+6×1/2+12×1/4+1=8,Al原子全部位于体内,共4个Al原子,所以该晶胞中Fe与Al的原子个数比是2:1,其化学式是Fe2Al;
②此合金中最近的两个Fe原子之间的距离为晶胞棱长的一半,设晶胞的棱长为xcm,则4×139/NA/a3=ρ ,所以a=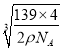 ,则此合金中最近的两个Fe原子之间的距离为a/2=
,则此合金中最近的两个Fe原子之间的距离为a/2=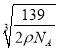 。
。
【考点地位】本题主要是考查晶体判断、核外电子排布、共价键、配位键、晶胞结构和计算等
【名师点晴】金属元素占元素总数的4/5, Fe、Al、Cu是日常生活、生产中用途广、用量大的常见金属。只有认识、了解和掌握金属元素的原子结构、晶体结构和性质,才能更好的发挥金属及合金材料的作用,发挥它的应用范围。通过晶胞中原子个数的计算和金属晶体的密度计算来考查考生的计算能力和应用知识解决问题的能力。考查了学生综合运用所学化学知识解决相关化学问题的能力。本题的解题要点为:掌握物质的性质、元素的原子序数、原子核外电子排布、原子的杂化、晶体的类型、晶体结构、晶体密度的计算方法。然后对各个问题进行逐一解答。难点也恰恰是晶胞的结构分析、判断与计算,注意均摊法和数学知识的迁移灵活应用。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。右图为RFC工作原理示意图,下列有关说法正确的是
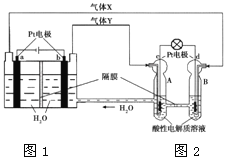
A. 图1把化学能转化为电能,图2把电能转化为化学能,水得到了循环使用
B. 当有0.1 mol电子转移时,a极产生0.56 L O2(标准状况下)
C. c极上发生的电极反应是:O2+ 4H++ 4e-= 2H2O
D. 图2中电子从c极流向d极,提供电能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气吹出法工艺是目前“海水提溴”的最主要方法之一。其工艺流程如下:
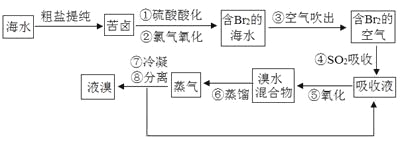
(1)步骤①中氯气氧化溴离子时在pH=3.5的酸性条件下效果最好,当使用精确pH试纸(能读数到0.1)检测步骤②氯气氧化的溶液的pH时,发现其颜色变化失常,则pH检测失败的原因是 。
(2)步骤④中反应的化学方程式为 ,该反应中体现了SO2的 性(填“氧化”或“还原”)。
(3)步骤⑧中溴蒸气冷凝后得到液溴与溴水的混合物,在实验室可用分液漏斗进行分离。分离时从分液漏斗的上口倒出的是 。
(4)步骤①、②之后并未直接用“含Br2的海水”进行蒸馏得到液溴,而是经过“空气吹出”、“SO2吸收”、“氧化”后再蒸馏,“空气吹出、SO2吸收、氧化”的过程实际上是一个Br2的 过程,与直接蒸馏含Br2的海水相比优点是消耗更少成本降低和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016届厦门一模】 NA为阿伏加德罗常数的值。有关草酸(HOOC-COOH)的下列说法错误的是
A.9.0g草酸中共用电子对数目为0.9NA
B.9.0 g草酸被NaClO氧化生成CO2,转移的电子数为0.2 NA
C.9.0 g草酸溶于水,其中C2O42-和HC2O4-的微粒数之和为0.1NA
D.9.0g草酸受热完全分解为CO2、CO、H2O,标况下测得生成的气体体积为4.48 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在C(s)+CO2(g)=2CO(g)的反应中,现采取下列措施:
①缩小体积,增大压强
②增加碳的量
③通入CO2
④恒容下充入N2
⑤恒压下充入N2
能够使反应速率增大的措施是
A.①④ B.②③⑤ C.①③ D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期A、B、C、D、E、F、G原子序数依次增大,A元素的质子数和质量数相等,B元素具有三个能级且所排电子数相同,D元素2p能级上电子数是2s能级的两倍;D和E相邻且同主族。F是第四周期未成对电子最多的原子,G是目前使用量最多的金属。
请回答下列问题:(用推出的元素符号或者化学式作答)
(1)F的价电子排布式为 ,B、C、D三种元素的第一电离能从大到小的顺序为 。
(2)![]() 中B原子的杂化方式为 ,该离子的空间构型为________
中B原子的杂化方式为 ,该离子的空间构型为________
(3)写出一种由A、C、D组成且既含离子键又含共价键的物质的化学式 ,化合物ABC中σ键和π键数目之比为 ,C的气态氢化物在一定的压强下,测得的密度比该压强下理论密度略大,请解释原因 。
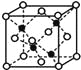
(4)E和G形成的某种晶胞如下图所示:其中白球表示E,黑球表示G。则该物质的化学式为 ,假设该晶胞的密度为ρ g/cm3,用NA表示阿伏加德罗常数,则该晶胞中距离最近的G原子之间的距离为 cm 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)将晶体X加热分解,可得A、B、D、E、F和水六种产物,其中A、B、D都是中学化学中常见的氧化物,气体E是单质F所含元素的氢化物。
(1)A能溶于强酸、强碱,写出A与强碱溶液反应的离子方程式_____________。
(2)B、D都是酸性氧化物且组成元素相同,D溶于水得强酸,则B、D分子中除氧元素外所含另一种元素在周期表中的位置是____________。
(3)E能使湿润的红色石蕊试纸变蓝,实验室制取E气体的化学方程式为__________,制得的气体可用如图所示装置收集,则气体应从______(填“A”或“B”)通入。
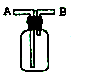
(4)由各分解产物的物质的量之比推测X的组成类似于明矾,若向X的浓溶液中滴加浓NaOH 溶液至过量,现象依次为_______、_________、__________。
(5)取一定量的X晶体分解,若生成F 1mol,则必同时生成____物质______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.用直接加热氧化铝的方法冶炼得到铝
B.海水中含有钾元素,只需经过物理变化可以得到钾单质
C.从海水中可以得到NaCl,电解熔融NaCl可制备Cl2
D.高炉炼铁的过程是通过置换反应得到铁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com