
【题目】在C(s)+CO2(g)=2CO(g)的反应中,现采取下列措施:
①缩小体积,增大压强
②增加碳的量
③通入CO2
④恒容下充入N2
⑤恒压下充入N2
能够使反应速率增大的措施是
A.①④ B.②③⑤ C.①③ D.①③④
科目:高中化学 来源: 题型:
【题目】厨房中的化学知识很多,下面是有关厨房中的常见操作或者常见现象,其中属于氧化还原反应的是
A. 食醋不慎洒落到大理石台面出现腐蚀现象
B. 做馒头用的发面中常加入少许碱面(小苏打)揉和
C. 烧菜用过的铁锅,经放置常出现红棕色斑迹
D. 粗盐潮解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可利用乙二醇、铜或铜的化合物制备乙二醛,下图是某兴趣小组设计的实验装置,右边的反应装置相同,而左边的气体发生装置不同,试管C中装有水(加热装置未画出)。试回答:
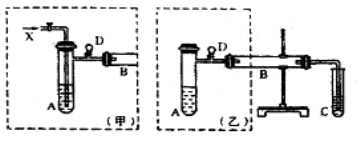
(1)两套装置中的A、B处都需加热,A处用水浴加热,A处用水浴加热的主要优点是 。
(2)若按甲装置进行实验,B管处装铜粉,通入A管的气体为X,B中反应的化学方程式为 。
(3)若按乙装置进行实验,则B管中应装 ,B中反应的化学方程式为 。
(4)实验完成时先打开D处的铁夹,再撤去酒精灯,这样做的目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无机物氰酸铵(NH4OCN)受热可转化为有机物尿素[CO(NH2)2],这一反应的发现使人类踏上了有机合成的征程。下列关于这两种物质的说法中正确的是
A.都属于铵盐
B.都属于离子化合物
C.互为同素异形体
D.互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应可视为旧键断裂和新键形成的过程。已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ·mol-1 ): P-P:198 P-O:360 O=O:498,则生成1 mol P4O6 该反应P4(白磷)+3O2=P4O6中的能量变化为

A.吸收1638 kJ能量 B.放出1638 kJ能量
C.吸收126 kJ能量 D.放出126 kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。单位质量的A和B单质燃烧时均放出大量热,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:

①某同学根据上述信息,推断B的核外电子排布如下图所示,该同学所画的电子排布图违背 ,B元素位于周期表五个区域中的 区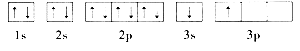
②ACl2分子中A的杂化类型为 ,ACl2的空间构型为 。
(2)Fe原子或离子外围有较多能量相近的空轨道能与一些分子或离子形成配合物。
①以体心立方堆积形成的金属铁中,其原子的配位数为 。
②写出一种与![]() 互为等电子体的单质的电子式 。
互为等电子体的单质的电子式 。
③六氰合亚铁离子![]() 中不存在 。
中不存在 。
A.共价键
B.非极性键
C.配位键
D.σ键
E.π键
(3)一种Al-Fe合金的立体晶胞如下图所示。请据此回答下列问题:
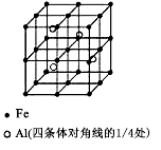
①确定该合金的化学式 。
②若晶体的密度=ρ g/cm3,则此合金中最近的两个Fe原子之间的距离(用含ρ的代数式表示,不必化简)为 cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是Zn和Cu形成的原电池,回答下列问题:
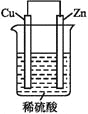
(1)正极发生____反应(选填“氧化”或“还原”),负极电极反应式为:____。
(2)电子流动方向,从____电极(选填“Cu”或“Zn”),经外电路,流向另一电极。阳离子向____电极定向移动(选填“Cu”或“Zn”)。
(3)有0.1 mol电子流过导线,则产生H2在标准状况下的体积为____,若是断开Zn和Cu之间的导线,产生气泡的速度____(选填“加快”、“不变”或“减慢”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于证明海带中存在碘元素的实验,以下操作正确的是
A.海带中的碘可以直接用四氯化碳萃取
B.在蒸发皿中灼烧海带使之变为海带灰
C.将海带灰溶于水中,滴加淀粉溶液,溶液变蓝
D.为了将I—氧化,加入的氧化剂最好选择H2O2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(10分)利用太阳光分解水制氢是未来解决能源危机的理想方法之一。某研究小组设计了如下图所示的循环系统实现光分解水制氢。反应过程中所需的电能由太阳能光电池提供,反应体系中I2和Fe2+等可循环使用。
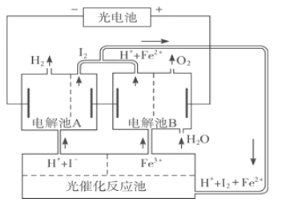
(1)写出电解池A、电解池B和光催化反应池中反应的离子方程式。
(2)若电解池A中生成3.36 L H2(标准状况),电解池B中生成Fe2+的物质的量为 。
(3)若循环系统处于稳定工作状态时,电解池A中流入和流出的HI浓度分别为a mol·L-1和b mol·L-1,光催化反应生成Fe3+的速率为c mol·L-1,循环系统中溶液的流量为Q(流量为单位时间内流过的溶液体积)。试用含所给字母的代数式表示溶液的流量Q。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com