
【题目】(10分)利用太阳光分解水制氢是未来解决能源危机的理想方法之一。某研究小组设计了如下图所示的循环系统实现光分解水制氢。反应过程中所需的电能由太阳能光电池提供,反应体系中I2和Fe2+等可循环使用。
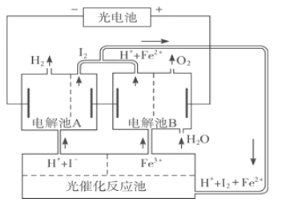
(1)写出电解池A、电解池B和光催化反应池中反应的离子方程式。
(2)若电解池A中生成3.36 L H2(标准状况),电解池B中生成Fe2+的物质的量为 。
(3)若循环系统处于稳定工作状态时,电解池A中流入和流出的HI浓度分别为a mol·L-1和b mol·L-1,光催化反应生成Fe3+的速率为c mol·L-1,循环系统中溶液的流量为Q(流量为单位时间内流过的溶液体积)。试用含所给字母的代数式表示溶液的流量Q。
【答案】
(1)电解池A:2H++2I-![]() H2↑+I2
H2↑+I2
电解池B:4Fe3++2H2O ![]() O2↑+4H++4Fe2+
O2↑+4H++4Fe2+
光催化反应池:2Fe2++I2![]() 2Fe3++2I-
2Fe3++2I-
(2)0.3 mol;
(3) c/(a-b)L·min-1
【解析】
试题分析:(1)由图可知,电解池A中,电解HI生成氢气与I2,电解池中总反应的离子方程式为:2H++2I-![]() H2↑+I2 ,电解池B中为电解铁盐溶液,生成Fe2+、O2、H+,电解池中总反应的离子方程式为:4Fe3++2H2O
H2↑+I2 ,电解池B中为电解铁盐溶液,生成Fe2+、O2、H+,电解池中总反应的离子方程式为:4Fe3++2H2O![]() 4Fe2++O2↑+4H+,光催化反应池中为Fe2+、I2、H+,生成Fe3+、I-、H+,光催化反应池中总反应的离子方程式为:2Fe2++I2
4Fe2++O2↑+4H+,光催化反应池中为Fe2+、I2、H+,生成Fe3+、I-、H+,光催化反应池中总反应的离子方程式为:2Fe2++I2![]() 2Fe3++2I-,故答案为:2H++2I-
2Fe3++2I-,故答案为:2H++2I-![]() H2↑+I2 ;4Fe3++2H2O
H2↑+I2 ;4Fe3++2H2O![]() 4Fe2++O2↑+4H+;2Fe2++I2
4Fe2++O2↑+4H+;2Fe2++I2![]() 2Fe3++2I-;
2Fe3++2I-;
(2)若电解池A中生成3.36LH2(标准状况),氢气的物质的量=![]() =0.15mol,转移电子物质的量=0.15mol×2=0.3mol,根据电子转移守恒,电解池B中生成Fe2+的物质的量为
=0.15mol,转移电子物质的量=0.15mol×2=0.3mol,根据电子转移守恒,电解池B中生成Fe2+的物质的量为![]() =0.3mol,故答案为:0.3mol;
=0.3mol,故答案为:0.3mol;
(3)若电解池A中流入和流出的HI浓度分别为amol/L和bmol/L,则单位时间内消耗的HI的物质的量为(a-b)×Qmol/L,根据反应方程式得失电子守恒,光催化反应池中单位时间内生成Fe3+的物质的量为cmol/min,则有(a-b)×Qmol/L=cmol/min,故答案为:Q=![]() L/min
L/min


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在C(s)+CO2(g)=2CO(g)的反应中,现采取下列措施:
①缩小体积,增大压强
②增加碳的量
③通入CO2
④恒容下充入N2
⑤恒压下充入N2
能够使反应速率增大的措施是
A.①④ B.②③⑤ C.①③ D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为短周期元素,A的M电子层有1个电子,B的最外层电子数为内层电子数的2倍,C的最高化合价为最低化合价绝对值的3倍,C与D同周期,D的原子半径小于C。
(1)B位于元素周期表第____周期第____族。
(2)C2-离子的结构示意图为____。A+、C2-、D-中离子半径最小的是____。(用具体离子符号表示)
(3)BC2与二氧化碳的结构相似,其结构式为____。A2C的电子式为____。
(4)A、D元素最高价氧化物对应水化物相互反应的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中,不能使酸性KMnO4溶液褪色的是( )
①乙烯 ②乙烷 ③乙苯 ④乙炔 ⑤二氧化硫 ⑥甲苯 ⑦苯 ⑧异戊二烯
A. ②③⑥ B. ②③⑤⑥⑦⑧ C. ②⑦ D. ②⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组将甲、乙、丙装置连接如图,除G、H外所有电极均为惰性电极。电解一段时间后,D电极质量增加。试回答下列问题:
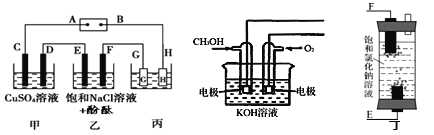
(1)电源A极是____极(填“正”或“负”);乙装置F电极附近的现象是____。
(2)欲用丙装置给铜镀银。G应该是____(填“Ag”或“Cu”)。
(3)如用甲醇燃料电池(如图)充当电源,写出负极的电极反应方程式:____;若用丁装置(如图)代替乙装置,写出丁装置中反应的总化学方程式是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.用直接加热氧化铝的方法冶炼得到铝
B.海水中含有钾元素,只需经过物理变化可以得到钾单质
C.从海水中可以得到NaCl,电解熔融NaCl可制备Cl2
D.高炉炼铁的过程是通过置换反应得到铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式,正确的是
A. 澄清石灰水中通入过量二氧化碳:Ca2+ +2OH +CO2 =CaCO3↓+H2O
B. 碳酸钠溶液中加入二氧化硅:CO32 +SiO2=SiO32 +CO2↑
C. 二氧化硅与烧碱溶液反应:SiO2 +2OH =SiO32+H2↑
D. 硅酸与烧碱溶液中和:H2SiO3 +2OH = SiO32+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ己知1 mol NO2和1mol CO反应生成CO2和NO过程中能量变化如下图所示。

(1)请写出NO2和CO反应的热化学方程式________________________。
Ⅱ某温度时,在0.5L密闭容器中,某一反应的A、B气体物质的量随时间变化的曲线如图所示,由图中数据分析求得:

(2)该反应的化学方程式为_________________。
(3)反应开始至4min时,B的平均反应速率为___________。
(4)第4min时,正、逆反应速率的大小关系为:v(正)_______v(逆)(填“>”、“<”或“=”,下同)。
(5)第8min时,v(正)______v(逆)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com