
【题目】把铝条放入盛有过量稀盐酸的试管中,不影响氢气产生速率的因素是( )
A.盐酸的浓度 B.铝条的表面积
C.溶液的温度 D.加少量固体NaCl
 一课一练课时达标系列答案
一课一练课时达标系列答案 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
【题目】(10分)利用太阳光分解水制氢是未来解决能源危机的理想方法之一。某研究小组设计了如下图所示的循环系统实现光分解水制氢。反应过程中所需的电能由太阳能光电池提供,反应体系中I2和Fe2+等可循环使用。
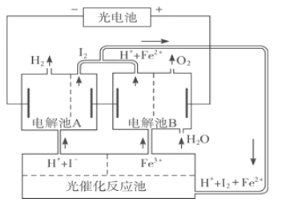
(1)写出电解池A、电解池B和光催化反应池中反应的离子方程式。
(2)若电解池A中生成3.36 L H2(标准状况),电解池B中生成Fe2+的物质的量为 。
(3)若循环系统处于稳定工作状态时,电解池A中流入和流出的HI浓度分别为a mol·L-1和b mol·L-1,光催化反应生成Fe3+的速率为c mol·L-1,循环系统中溶液的流量为Q(流量为单位时间内流过的溶液体积)。试用含所给字母的代数式表示溶液的流量Q。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用食盐和石灰石为主要原料,经不同的方法生产纯碱。请回答下列问题:
(1)卢布兰芳是以食盐、石灰石、浓硫酸、焦炭为原料,在高温下进行煅烧,再浸取,结晶而制得纯碱。
①食盐和浓硫酸反应的化学方程式为 _;
②硫酸钠和焦炭、石灰石反应的化学方程式为_ (已知产物之一为CaS);
(2)氨碱法的工艺如下图所示,得到的碳酸氢钠经煅烧生成纯碱。
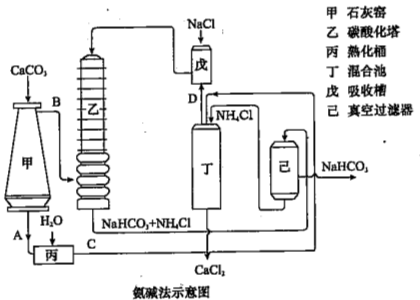
①图中的中间产物C是_______,D_______。(写化学式);
②装置乙中发生反应的化学方程式为 ;
(3)联合制碱法对氨碱法的改进,其优点是 ;
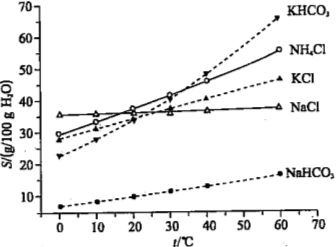
(4)有人认为碳酸氢钾与碳酸氢钠的化学性质相似,故也可用氨碱法以氯化钾和石灰石为原料制碳酸钾。请结合下图的溶解度(S)随温度变化曲线,分析说明是否可行?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-、SO42-,现取三份100mL溶液进行如下实验:
①第一份加足量AgNO3溶液后,有白色沉淀产生。
②第二份加足量BaCl2溶液后,有白色沉淀产生,经洗涤、干燥后,沉淀质量为6.99 g。
③第三份逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图。
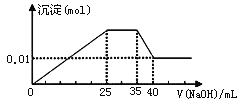
根据上述实验,以下推测不正确的是
A. 原溶液一定不存在H+、Cu2+、CO32-
B. 不能确定原溶液是否含有K+、NO3-
C. 实验所加的NaOH的浓度为2mol·L-1
D. 原溶液确定含Mg2+、Al3+、NH4+,且n(Mg2+):n(Al3+):n( NH4+)=1:1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将质量为12.64g KMnO4固体加热一段时间后,收集到amolO2;向反应后残留的固体中加入足量的浓盐酸,又收集到bmolCl2,此时Mn元素全部以Mn2+的形式存在于溶液中。
(1)请完成并配平下列化学方程式:
K2MnO4+ HCl - KCl+ MnCl2+ Cl2↑+________□
该反应中的还原剂是 ,当该反应中转移NA个电子时,氧化产物的物质的量为 mol,被氧化的还原剂的物质的量为 mol。
(2)用酸性高锰酸钾溶液滴定FeSO4溶液写出该反应的离子方程式 。
(3)当KMnO4固体加热生成O2 a mol值最大时,向反应后残留的固体中加入足量的浓盐酸并加热,产生Cl2的物质的量b= mol。(此时Mn元素全部以Mn2+的形式存在于溶液中)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰及其化合物有广泛应用。
(1)在稀硫酸酸化的双氧水中加入二氧化锰粉末,产生大量气泡,且黑色固体消失;向反应完全后的溶液中加入高锰酸钾溶液生成黑色沉淀。经检测:1mol KMnO4完全反应转移3mol电子。在双氧水参与的反应中,二氧化锰除了作催化剂还作 ;写出加入高锰酸钾后产生黑色沉淀的离子方程式 。
(2)菱锰矿是生产铁锰合金中锰的来源,其主要成分是碳酸锰。已知锰常见的化合价有+2、+4、+6、+7。在空气中灼烧菱锰矿生产四氧化三锰,然后用铝热反应制备锰。写出菱锰矿粉末在空气中高温灼烧生成四氧化三锰的化学方程式 。如果冶炼1100kg锰,理论上消耗铝的质量为 kg。

(3)工业生产中为了制备硫酸锰,往往将硫酸锰溶液中亚铁离子氧化成铁离子,调节pH除去铁离子。向混合溶液中滴加稀硫酸酸化,加入软锰矿(主要成分是二氧化锰)氧化亚铁离子,写出该过程的离子方程式 。
(4)酸性高锰酸钾可氧化乙醇,配平下列反应方程式:
KMnO4+ H2SO4+ CH3CH2OH= K2SO4+ MnSO4+ CH3COOH+ □。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用下图所示的装置制取乙酸乙酯。回答下列问题:
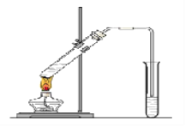
(1)写出制取乙酸乙酯的化学反应方程式: 。
(2)饱和碳酸钠溶液的主要作用是: 。
(3)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是: 。
(4)应结束后,振荡试管b,静置。观察到的现象是 。
(5)若要把制得的乙酸乙酯分离出来,应采用的实验操作是(填名称): 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合理使用药物是保证身心健康、提高生活质量的有效手段。药物化学已经成为化学的一个重要领域。
(1)我国科学家屠呦呦因发现治疗疟疾的特效药——青蒿素,而获得2015年诺贝尔生理学或医学奖。青蒿素的结构简式如下图所示,其中的过氧基(—O—O—)具有强氧化性。请回答下列问题:

①青蒿素的分子式为 ;
②下列有关青蒿素的叙述中,正确的是 填字母).
A.青蒿素属于芳香族化合物
B.青蒿素具有强氧化性,可用于杀菌
C.青蒿素分子中的所有碳原子在同一个平面上
D.在一定条件下,青蒿素能与NaOH溶液发生反应
(2)阿司匹林(乙酰水杨酸)![]() 是常用的解热镇痛药,可以由水杨酸与乙酸酐反应制取,反应原理为:
是常用的解热镇痛药,可以由水杨酸与乙酸酐反应制取,反应原理为:

请回答下列问题:
①制得的阿司匹林中常含有少量的杂质水杨酸,下列试剂可用于检验阿司匹林样品中是否混有水杨酸的是 (填字母).
A、碳酸氢钠溶液 B、三氯化铁溶液 C、石蕊试液
②写出水杨酸与足量的NaHCO3溶液完全反应所得有机产物的结构简式 ;
③1mol乙酰水杨酸与足量的NaOH溶液反应,最多消耗NaOH物质的量为 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物中碳原子和氢原子个数比为3∶4,不能与溴水反应却能使酸性KMnO4溶液褪色。其蒸气密度是相同状况下甲烷密度的7.5倍。在铁存在时与溴反应,能生成两种一溴代物。该有机物可能是
A. CH≡C-CH3
B. ![]()
C. CH2=CHCH3
D. 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com