
����Ŀ����ҵ�Ͽ���ʳ�κ�ʯ��ʯΪ��Ҫԭ��������ͬ�ķ������������ش��������⣺
��1��¬����������ʳ�Ρ�ʯ��ʯ��Ũ���ᡢ��̿Ϊԭ�ϣ��ڸ����½������գ��ٽ�ȡ���ᾧ���Ƶô��
��ʳ�κ�Ũ���ᷴӦ�Ļ�ѧ����ʽΪ _��
�������ƺͽ�̿��ʯ��ʯ��Ӧ�Ļ�ѧ����ʽΪ_ ����֪����֮һΪCaS����
��2������Ĺ�������ͼ��ʾ���õ���̼�����ƾ��������ɴ��
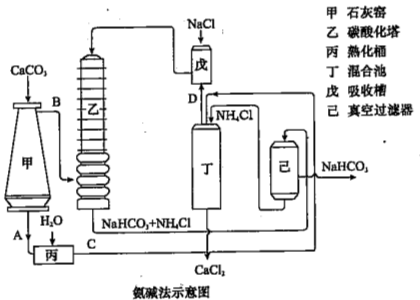
��ͼ�е��м����C��_______��D_______����д��ѧʽ����
��װ�����з�����Ӧ�Ļ�ѧ����ʽΪ ��
��3�������Ƽ����ĸĽ������ŵ��� ��
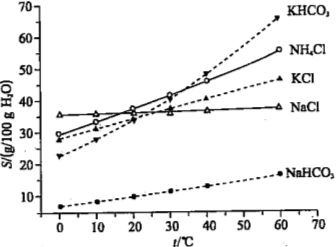
��4��������Ϊ̼�������̼�����ƵĻ�ѧ�������ƣ���Ҳ���ð�����Ȼ��غ�ʯ��ʯΪԭ����̼��ء�������ͼ���ܽ�ȣ�S�����¶ȱ仯���ߣ�����˵���Ƿ���У�
���𰸡�
��1����NaCl+H2SO4(Ũ)=NaHSO4+HCl����2NaCl+H2SO4(Ũ) ![]() Na2SO4+2HCl����
Na2SO4+2HCl����
��Na2SO4+ 2C+CaCO3 ![]() CaS+Na2CO3+2CO2����
CaS+Na2CO3+2CO2����
��2����Ca(OH)2��NH3����NH3 + CO2 +NaCl +H2O = NaHCO3��+ NH4Cl ��
��3�����ʳ�������ʡ��������Ȼ�刺��������ʡ������úϳɰ��IJ���CO2.��
��4������������ΪKHCO3���ܽ�Ƚϴ����ڳ�������KCl�ܽ�����С�������ˮ̼�ữʱ������������
��������
�����������1�������ø߷е����Ʊ��ӷ����ᣬ��HCl��������ˮ��������ֱ��ʹ��98%Ũ������Ȼ�����ȡ�Ȼ��⣬��ӦΪ��NaCl+H2SO4��Ũ��![]() NaHSO4+HCl����2NaCl+H2SO4��Ũ��
NaHSO4+HCl����2NaCl+H2SO4��Ũ��![]() Na2SO4+2HCl�����ʴ�Ϊ��NaCl+H2SO4��Ũ��
Na2SO4+2HCl�����ʴ�Ϊ��NaCl+H2SO4��Ũ��![]() NaHSO4+HCl����2NaCl+H2SO4��Ũ��
NaHSO4+HCl����2NaCl+H2SO4��Ũ��![]() Na2SO4+2HCl����
Na2SO4+2HCl����
������Ŀ��Ϣ��֪����������ʯ��ʯ����̿��Ӧ����CaS��Na2CO3������Ԫ���غ��֪����ԭC��������CO��CO2���ɣ��ʷ�Ӧ����ʽΪ��Na2SO4+4C+CaCO3![]() CaS+Na2CO3+4CO��Na2SO4+2C+CaCO3
CaS+Na2CO3+4CO��Na2SO4+2C+CaCO3 ![]() CaS+Na2CO3+2CO2���ʴ�Ϊ��Na2SO4+4C+CaCO3
CaS+Na2CO3+2CO2���ʴ�Ϊ��Na2SO4+4C+CaCO3![]() CaS+Na2CO3+4CO��Na2SO4+2C+CaCO3
CaS+Na2CO3+4CO��Na2SO4+2C+CaCO3 ![]() CaS+Na2CO3+2CO2��
CaS+Na2CO3+2CO2��
��2����̼��Ƽ��ȷֽ�����CaO��CO2����AΪCaO��BΪCO2��CaO���컯Ͱ����ˮ��Ӧ�����������ƣ���CΪCa��OH��2�������������Ȼ���ڻ�ϳ��ڷ�Ӧ���ɰ������Ȼ��ƣ���DΪNH3���ʴ�Ϊ��Ca��OH��2��NH3��
���������Ȼ�����Һ��Ϻ��������������̼������Ӧ������NaHCO3��NH4Cl����Ӧ����ʽΪNH3+CO2+NaCl+H2O=NaHCO3+NH4Cl���ʴ�Ϊ��NH3+CO2+NaCl+H2O=NaHCO3+NH4Cl��
��3���÷��������ԭ�ϵ������ʣ����ٷ������ŷţ������˰�����ŵ㣬����������ȱ�㣬ʹʳ�ε���������ߣ�NH4Cl �������ʣ�����ϳɰ������ϣ������úϳɰ��IJ���CO2���ʴ�Ϊ�����ʳ�������ʡ��������Ȼ�刺��������ʡ������úϳɰ��IJ���CO2��
��4�����ܽ�����ͼ��֪KHCO3��NH4Cl���ܽ�������¶ȸ���40��ʱ����ͼ���֪�����½ᾧʱ�������϶��KCl������������̼����أ��ʴ�Ϊ�������У� ��ΪKHCO3���ܽ�Ƚϴ����ڳ�������KCl�ܽ�����С�������ˮ̼�ữʱ������������


 ���Ž�������С״Ԫϵ�д�
���Ž�������С״Ԫϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��DΪ������Ԫ�أ�A��M���Ӳ���1�����ӣ�B������������Ϊ�ڲ��������2����C������ϼ�Ϊ��ͻ��ϼ۾���ֵ��3����C��Dͬ���ڣ�D��ԭ�Ӱ뾶С��C��
��1��Bλ��Ԫ�����ڱ���____���ڵ�____�塣
��2��C2-���ӵĽṹʾ��ͼΪ____��A+��C2-��D-�����Ӱ뾶��С����____�����þ������ӷ��ű�ʾ��
��3��BC2�������̼�Ľṹ���ƣ���ṹʽΪ____��A2C�ĵ���ʽΪ____��
��4��A��DԪ������������Ӧˮ�������Ӧ�Ļ�ѧ����ʽΪ____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ����ȷ����
A. ����ʯ��ˮ��ͨ�����������̼��Ca2+ +2OH +CO2 ��CaCO3��+H2O
B. ̼������Һ�м���������裺CO32 +SiO2��SiO32 +CO2��
C. �����������ռ���Һ��Ӧ��SiO2 +2OH ��SiO32+H2��
D. �������ռ���Һ�кͣ�H2SiO3 +2OH �� SiO32+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������֪1 mol NO2��1mol CO��Ӧ����CO2��NO�����������仯����ͼ��ʾ��

��1����д��NO2��CO��Ӧ���Ȼ�ѧ����ʽ________________________��
��ij�¶�ʱ����0.5L�ܱ������У�ijһ��Ӧ��A��B�������ʵ�����ʱ��仯��������ͼ��ʾ����ͼ�����ݷ�����ã�

��2���÷�Ӧ�Ļ�ѧ����ʽΪ_________________��
��3����Ӧ��ʼ��4minʱ��B��ƽ����Ӧ����Ϊ___________��
��4����4minʱ�������淴Ӧ���ʵĴ�С��ϵΪ��v������_______v���棩��������������<������=������ͬ����
��5����8minʱ��v������______v���棩��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڷ�ӦA(g)+3B(g��![]() 2C(g)+2D(g)��˵���������ֲ�ͬ����µķ�Ӧ����������
2C(g)+2D(g)��˵���������ֲ�ͬ����µķ�Ӧ����������
A��v (A��=0.15 mol/(Ls��
B��v(B��=0.6 mol/(Ls)
C��v(C��=0.4 mol/(Ls��
D��v(D��=0.45 mol/(Ls)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ�����(S2Cl2)�ǹ㷺������ҵ����������ӽṹ����ͼ��ʾ��������S2Cl2��һ�ֳȻ�ɫ��Һ�壬��ˮ��ˮ�⣬������ʹƷ����ɫ���������������˵���������ǣ� ��

A��S2Cl2Ϊ���м��Լ��ͷǼ��Լ��ķǼ��Է���
B��S2Cl2�ĽṹʽΪCl��S��S��Cl
C��S2Br2��S2Cl2�ṹ���ƣ��۷е㣺S2Br2��S2Cl2
D��S2Cl2��H2O��Ӧ�Ļ�ѧ����ʽ����Ϊ��2S2Cl2+2H2O=SO2��+3S��+4HCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijý���ԡ��й���������ŷ�˸��ż���Ϊ�⣬�������ҹ��㶫ij�������Ľ��ͺܿ�����ŷ���г��������̣��Ӷ�ʧȥ��������Ԫ�ķݶ�һ�£���ԭ���ǽ����е��ȱ������س��꣮���ȱ�����������ֻ��һ���ǻ�����ͬ���칹���У���OH����Cl����ͬһ��Cԭ���ϣ��� ��
A. 3�� B. 4�� C. 5�� D. 6��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ʢ�й���ϡ������Թ��У���Ӱ�������������ʵ�������( )
A�������Ũ�� B�������ı����
C����Һ���¶� D������������NaCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ�绯ѧװ�ã�����ͼ��ʾ��E Ϊմ�� Na2SO4��Һ����ֽ�������뼸�η�̪��A��B�ֱ�ΪPtƬ��ѹ����ֽ���ˣ�R��SΪ��Դ�ĵ缫��M��N���ö��� Ni �Ƴɵĵ缫���ϣ����ڼ�����Һ�п�����Ϊ���Ե缫��GΪ�����ƣ�KΪ���ء�C��D�͵����ж�����ŨKOH��Һ��������ֽ�������һ����ɫ�� KMnO4��Һ���Ͽ�K����ͨ���Դһ��ʱ���C��D�������������

��1��SΪ________�����������)����
��2��A��������Һ��������______________�� B �����������ĵ缫��ӦʽΪ___________��
��3����ֽ�ϵ���ɫ����______���A����B��)���ƶ���
��4���� C��D������������һ����ʱ���ж����Դ����ͨ����K������һ��ʱ�䣬C��D���������٣�D�еĵ缫Ϊ________ �����������)�����缫��ӦʽΪ___________________________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com