
【题目】对于反应A(g)+3B(g)![]() 2C(g)+2D(g)来说,下列四种不同情况下的反应速率最快的是
2C(g)+2D(g)来说,下列四种不同情况下的反应速率最快的是
A.v (A)=0.15 mol/(Ls)
B.v(B)=0.6 mol/(Ls)
C.v(C)=0.4 mol/(Ls)
D.v(D)=0.45 mol/(Ls)
科目:高中化学 来源: 题型:
【题目】对乙酰氨基苯酚M(![]() )是最常见的消炎解热镇痛药,用于治疗感冒发烧和关节痛等。M的一种合成路线如下:
)是最常见的消炎解热镇痛药,用于治疗感冒发烧和关节痛等。M的一种合成路线如下:
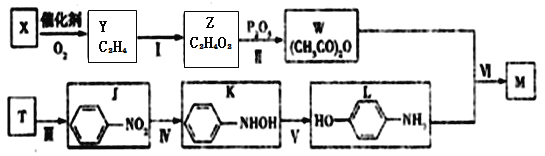
已知:①X、Y、T分子的核碰共振氢谱只显示1组峰,且X能使溴水褪色;
②![]() 。
。
(1)X、Y的结构简式为 、 ;
(2)Ⅲ的反应类型为 ,Ⅵ的反应方程式为 ;
(3)M与足量氢氧化钠溶液反应的化学方程式为 ;
(4)M有多种同分异构体,其中一类与J互为同系物且氮原子与苯环直接相连,此类同分异构体共有 种;另一类同分异构体同时满足下列条件①属于对位二取代苯且苯环上连有—NH2;②能发生水解反应;③核碰共振氢谱有4组峰。写出其中一种同分异构体的结构简式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 按系统命名,有机物CH3CH(C2H5)CH(CH3)2的名称是 ( )
A.1,3-二甲基戊烷 B.2-甲基-3-乙基丁烷
C.3,4-二甲基戊烷 D.2,3-二甲基戊烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是
A. 加热
B. 不用稀硫酸,改用98%的硫酸
C. 滴加少量CuSO4溶液
D. 不用铁片,改用铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ如图A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。
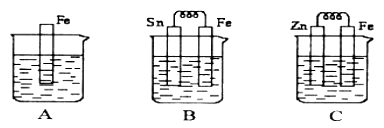
(1)B中Sn极上出现的现象________________;
(2)C中Zn片上的电极反应式为____________________;
(3)A、B、C中铁溶解的速率由快到慢的顺序是_______________。
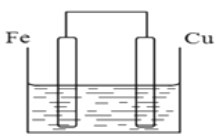
Ⅱ(4)若将质量相等的铁片和铜片用导线相连浸入硫酸铜溶液中构成原电池,如图,一段时间后,两电极质量相差1.2g,则导线中通过的电子的物质的量为_______________。
Ⅲ下图是一个化学过程的示意图,回答下列问题:
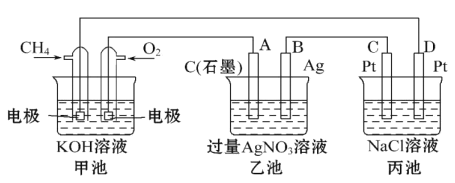
(5)甲装置中通入CH4的电极反应式为_____________________,
(6)从能量转化的角度分析,乙池是_____转化为_________的装置。
(7 )一段时间,当丙池中产生112 mL(标准状况下)气体时,均匀搅拌丙池,所得溶液在25℃时的物质的量浓度为________________。(己知:NaCl溶液足量,电解后溶液体积为500 mL)。
(8)若要使丙池恢复电解前的状态,应向丙池中通入_______(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可用食盐和石灰石为主要原料,经不同的方法生产纯碱。请回答下列问题:
(1)卢布兰芳是以食盐、石灰石、浓硫酸、焦炭为原料,在高温下进行煅烧,再浸取,结晶而制得纯碱。
①食盐和浓硫酸反应的化学方程式为 _;
②硫酸钠和焦炭、石灰石反应的化学方程式为_ (已知产物之一为CaS);
(2)氨碱法的工艺如下图所示,得到的碳酸氢钠经煅烧生成纯碱。
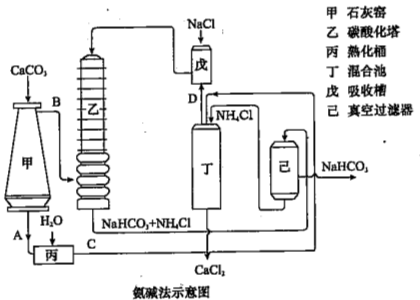
①图中的中间产物C是_______,D_______。(写化学式);
②装置乙中发生反应的化学方程式为 ;
(3)联合制碱法对氨碱法的改进,其优点是 ;
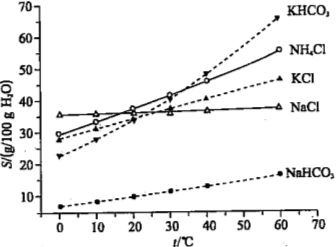
(4)有人认为碳酸氢钾与碳酸氢钠的化学性质相似,故也可用氨碱法以氯化钾和石灰石为原料制碳酸钾。请结合下图的溶解度(S)随温度变化曲线,分析说明是否可行?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH)是重要的溶剂和替代燃料,工业常以CO和H2的混合气体为原料一定条件下制备甲醇。
(1)甲醇与乙醇互为 ;完全燃烧时,甲醇与同物质的量的汽油(设平均组成为C8H18)消耗O2量之比为 。
(2)工业上常用“水煤气法”获得CO和H2,其反应原理如下:
C(s) + H2O(g) ![]() CO(g) + H2(g) CO(g) + H2O(g)
CO(g) + H2(g) CO(g) + H2O(g) ![]() CO2(g) + H2(g)
CO2(g) + H2(g)
某水煤气样品中含0.2LCO、0.5LCO2,则该样品中含H2 L。
(3)工业上还可以通过下列途径获得H2,其中节能效果最好的是 。
A. 高温分解水制取H2:2H2O![]() 2H2↑+ O2↑
2H2↑+ O2↑
B. 电解水制取H2:2H2O![]() 2H2↑+ O2↑
2H2↑+ O2↑
C. 甲烷与水反应制取H2:CH4 + H2O![]() 3H2 + CO
3H2 + CO
D. 在光催化剂作用下,利用太阳能分解水制取H2:2H2O![]() 2H2↑+ O2↑
2H2↑+ O2↑
(4)在2L的密闭容器中充入1molCO和2molH2,一定条件下发生反应:CO(g)+2H2(g) ![]() CH3OH(g) 测得CO和CH3OH(g)浓度变化如图所示。
CH3OH(g) 测得CO和CH3OH(g)浓度变化如图所示。

① 从反应开始到平衡,氢气的平均反应速率v(H2)= mol·(L·min)—1。
② 能够判断该反应达到平衡的是 (填选项)。
A.CO、H2和CH3OH三种物质的浓度相等
B.密闭容器中混合气体的密度不再改变
C.CH3OH分解的速率和CH3OH生成的速率相等
D.相同时间内消耗1 mol CO,同时消耗1 mol CH3OH
(5)为使合成甲醇原料的原子利用率达100%,实际生产中制备水煤气时还使用CH4,则生产投料时,n(C)∶n(H2O)∶n(CH4)= 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将质量为12.64g KMnO4固体加热一段时间后,收集到amolO2;向反应后残留的固体中加入足量的浓盐酸,又收集到bmolCl2,此时Mn元素全部以Mn2+的形式存在于溶液中。
(1)请完成并配平下列化学方程式:
K2MnO4+ HCl - KCl+ MnCl2+ Cl2↑+________□
该反应中的还原剂是 ,当该反应中转移NA个电子时,氧化产物的物质的量为 mol,被氧化的还原剂的物质的量为 mol。
(2)用酸性高锰酸钾溶液滴定FeSO4溶液写出该反应的离子方程式 。
(3)当KMnO4固体加热生成O2 a mol值最大时,向反应后残留的固体中加入足量的浓盐酸并加热,产生Cl2的物质的量b= mol。(此时Mn元素全部以Mn2+的形式存在于溶液中)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为4种常见溶液中溶质的质量分数和物质的量浓度:
溶 质 | HCl | NaOH | CH3COOH | HNO3 |
溶质的质量分数/% | 36.5 | 40 | 60 | 63 |
物质的量浓度/mol·L-1 | 11.8 | 14.3 | 10.6 | 13.8 |
这4种溶液中密度最小的是( )
A.HCl B.NaOH C.CH3COOH D.HNO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com