
����Ŀ�������dzµ��㡱��������Ϊ���ڴ������������������ζ��������������ʵ��������Ҳ��������ͼ��ʾ��װ����ȡ�����������ش��������⣺
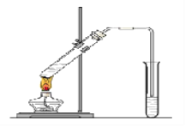
��1��д����ȡ���������Ļ�ѧ��Ӧ����ʽ�� ��
��2������̼������Һ����Ҫ�����ǣ� ��
��3��װ����ͨ�����ĵ���Ҫ���ڱ���̼������Һ��Һ���ϣ����ܲ�����Һ�У�Ŀ����: ��
��4��Ӧ���������Թ�b�����á��۲쵽�������� ��
��5����Ҫ���Ƶõ������������������Ӧ���õ�ʵ������ǣ����������� ��
���𰸡���1�� 
��2���кͻӷ����������ᣬʹ֮ת��Ϊ����������ˮ�У�������������������ζ���ܽ�ӷ��������Ҵ�����������������ˮ�е��ܽ�ȣ����ڷֲ�õ�����
��3�� ��ֹ���� ��4���ֲ㣬�ϲ�����״�� ��5����Һ
��������
�����������1��������Ҵ���Ũ���������������ȵ������·�����Ӧ����������������ѧ����ʽΪ��

��2��������Ҵ��ķе�ϵͣ��ӷ����Ƶõ����������к����Ҵ����������ʣ�������̼������Һ����Ҫ�������кͻӷ����������ᣬʹ֮ת��Ϊ����������ˮ�У�������������������ζ���ܽ�ӷ��������Ҵ�����������������ˮ�е��ܽ�ȣ����ڷֲ�õ�����
��3��Ϊ��ֹ�����������ĵ���Ҫ���ڱ���̼������Һ��Һ���ϣ����ܲ�����Һ�С�
��4������������������ˮ����״Һ�壬�ܶȱ�ˮС����Ӧ���������Թ�b�����ã��۲쵽�������Ƿֲ㣬�ϲ�����״�
��5�����뻥�����ܵ�����Һ��ķ����÷�Һ����ʵ������Ƿ�Һ��


 �����ҵ��ٿ���������������ϵ�д�
�����ҵ��ٿ���������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ����ȷ����
A. ����ʯ��ˮ��ͨ�����������̼��Ca2+ +2OH +CO2 ��CaCO3��+H2O
B. ̼������Һ�м���������裺CO32 +SiO2��SiO32 +CO2��
C. �����������ռ���Һ��Ӧ��SiO2 +2OH ��SiO32+H2��
D. �������ռ���Һ�кͣ�H2SiO3 +2OH �� SiO32+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijý���ԡ��й���������ŷ�˸��ż���Ϊ�⣬�������ҹ��㶫ij�������Ľ��ͺܿ�����ŷ���г��������̣��Ӷ�ʧȥ��������Ԫ�ķݶ�һ�£���ԭ���ǽ����е��ȱ������س��꣮���ȱ�����������ֻ��һ���ǻ�����ͬ���칹���У���OH����Cl����ͬһ��Cԭ���ϣ��� ��
A. 3�� B. 4�� C. 5�� D. 6��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ʢ�й���ϡ������Թ��У���Ӱ�������������ʵ�������( )
A�������Ũ�� B�������ı����
C����Һ���¶� D������������NaCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϡ�����м���ͭ��,ͭ�۲��ܽ�,�ټ������й����ĩ:��FeCl2;��Fe2O3;��Zn;��KNO3,ͭ�ۿ��ܽ����
A. �٢� B. �ڢ� C. �ڢ� D. �٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����෨��һ����֮��Ч�������еĿ�ѧ������ijͬѧ���±���ʾ��ʽ����ѧ֪ʶ���з��࣬���м����ҡ��������ǰ�����ϵ�����и����У�����ȷ�������
ѡ�� | �� | �ҡ������� |
A | ������ | Һ�ȡ�FeO��Fe2O3������ |
B | �ǵ���� | CO2��SO2���Ҵ� |
C | ������� | CH3COOH ����ˮ��H2O |
D | ǿ����� | HCl��NaOH��BaSO4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ԫ�ص��ʼ��仯�����й㷺��;����������ڱ��е�������Ԫ�����֪ʶ�ش��������⣺
��1����ԭ������������˳��(ϡ���������)������˵����ȷ����
a��ԭ�Ӱ뾶�����Ӱ뾶����С
b�������Լ������ǽ�������ǿ
c���������Ӧ��ˮ������Լ�����������ǿ
d�����ʵ��۵㽵��
��2��ԭ�������������������������ͬ��Ԫ������Ϊ �������������ļ��������� ��
��3����֪��
������ | MgO | Al2O3 | MgCl2 | AlCl3 |
���� | ���ӻ����� | ���ӻ����� | ���ӻ����� | ���ۻ����� |
�۵�/�� | 2800 | 2050 | 714 | 191 |
��ҵ��þʱ�����MgCl2�������MgO��ԭ���� ��
����ʱ�����Al2O3�������AlCl3��ԭ���� ��
��4�������(�۵�1410 ��)�����õİ뵼����ϡ��ɴֹ��ƴ���������£�
![]()
д��SiCl4�ĵ���ʽ�� ����������SiCl4�ƴ���ķ�Ӧ�У����ÿ����1.12 kg����������a kJ������д���÷�Ӧ���Ȼ�ѧ����ʽ��
��5��P2O5�Ƿ������Ը�������������岻����Ũ����������P2O5�������
a��NH3 b��HI c��SO2 d��CO2
��6��KClO3������ʵ������O2�������Ӵ�����400 ��ʱ�ֽ�ֻ���������Σ�����һ�����������Σ���һ���ε��������Ӹ�����Ϊ1��1��д���÷�Ӧ�Ļ�ѧ����ʽ��
��7����ҵ�ϣ�ͨ������ת�����Ƶ�KClO3���壺![]()
������з�Ӧ���ܻ�ѧ����ʽ��
![]()
���÷�Ӧ����������KClO3���������������������ԭ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ�绯ѧװ�ã�����ͼ��ʾ��E Ϊմ�� Na2SO4��Һ����ֽ�������뼸�η�̪��A��B�ֱ�ΪPtƬ��ѹ����ֽ���ˣ�R��SΪ��Դ�ĵ缫��M��N���ö��� Ni �Ƴɵĵ缫���ϣ����ڼ�����Һ�п�����Ϊ���Ե缫��GΪ�����ƣ�KΪ���ء�C��D�͵����ж�����ŨKOH��Һ��������ֽ�������һ����ɫ�� KMnO4��Һ���Ͽ�K����ͨ���Դһ��ʱ���C��D�������������

��1��SΪ________�����������)����
��2��A��������Һ��������______________�� B �����������ĵ缫��ӦʽΪ___________��
��3����ֽ�ϵ���ɫ����______���A����B��)���ƶ���
��4���� C��D������������һ����ʱ���ж����Դ����ͨ����K������һ��ʱ�䣬C��D���������٣�D�еĵ缫Ϊ________ �����������)�����缫��ӦʽΪ___________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Һʱ����������������ڵ����ʣ����в���Ϊ����������ˮ�����
A��FeSO4(Fe) B��SnCl2(HCl) C��FeCl3(HCl) D��NaAlO2(NaOH)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com