
����Ŀ������������(Na2S2O3)�dz��õ�ʳƷ��������֮һ���ڿ����б��������ɵIJ���ΪNa2SO4.ijС���������ʵ�飺
ʵ��һ ���������Ƶ���ȡ
������ͼװ��(ʵ��ǰ�ѳ���װ���ڵĿ���)��ȡNa2S2O5��װ��II����Na2S2O5���������������ķ�ӦΪ��Na2SO3+SO2=Na2S2O5
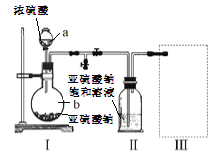
��1������a��b�����Ʒֱ���_________��__________��
��2��װ��I�в�������Ļ�ѧ����ʽΪ__________��
��3��Ҫ��װ��II�л���������ľ��壬�ɲ��õķ��뷽����__________���÷����õ��IJ����������ձ���©������___________��
��4��װ��III���ڴ���β������ѡ�õ������װ��(�г���������ȥ)Ϊ_________(�����)��
ʵ��� ���������Ƶ�����
Na2S2O5����ˮ������NaHSO3
��5��NaHSO3��Һ��HSO3-�ĵ���̶ȴ���ˮ��̶ȣ��ɲ��õ�ʵ�鷽����_________(�����)��
A���ⶨ��Һ��pH
B������Ba(OH)2��Һ
C����������
D������Ʒ����Һ
E.����ɫʯ����ֽ���
��6������Na2S2O5�����ڿ������ѱ�������ʵ�鷽����________��
���𰸡�
��1����Һ©����Բ����ƿ��
��2��Na2SO3+H2SO4=Na2SO4+SO2��+H2O��
��3�����ˡ���������
��4��d��
��5��a��e��
��6��ȡ����Na2S2O5�������Թ��м�������ˮ��Һ���μ������������ٵ����Ȼ�����Һ���а�ɫ�������ɡ�
��������
�����������1������װ��ͼ������aΪ��Һ©����bΪԲ����ƿ���ʴ�Ϊ����Һ©����Բ����ƿ��
��2����װ�����з����ķ�Ӧ��֪��װ�����в���������ΪSO2���������������ᷴӦ���������ơ�����������ˮ����Ӧ����ʽΪ��Na2SO3+H2SO4=Na2SO4+SO2��+H2O���ʴ�Ϊ��Na2SO3+H2SO4=Na2SO4+SO2��+H2O��
��3��װ�����л���������ľ��壬���������Һ̬��Ӧ��ȡ���˽��з��룬���˳��ձ���©�����貣�������ʴ�Ϊ�����ˣ���������
��4��a��װ��Ӧ���������백ˮ�п������ն�������Ϊ�ܱջ�����װ����ѹǿ�����ײ�����ȫ�¹ʣ��ʴ���b����װ�����ն������������ϲ��Ϊ�ܱջ�����װ����ѹǿ�����ײ�����ȫ�¹ʣ��ʴ���c����װ�ò������ն�������������ʵ��ʵ��Ŀ�ģ��ʴ���d����װ���������������������Ӧ���������գ��ҷ�ֹ����������ȷ���ʴ�Ϊ��d��
��5��NaHSO3��Һ��HSO3-�ĵ���̶ȴ���ˮ��̶ȣ���Һ�����ԣ��ⶨ��Һ��pH������ȷ����Һ����ԣ�������Һ����ʹʪ����ɫʯ����ֽ��죬�������òⶨ��ҺpHֵ��ʪ�����ɫʯ����Һ���飬������Ba(OH)2��Һ��HCl��Һ��Ʒ����Һ������˵����Һ�����ԣ���ѡae���ʴ�Ϊ��ae��
��6��Na2S2O5��SԪ�صĻ��ϼ�Ϊ+4�ۣ���˻ᱻ����ΪΪ+6�ۣ��������ڿ������ױ�����ΪNa2SO4�������ᡢ�Ȼ�����Һ������Ʒ���Ƿ�����������ɣ�ʵ�鷽��Ϊ��ȡ����Na2S2O5�������Թ��У���������ˮ�ܽ⣬�μ����ᣬ���ٵμ��Ȼ�����Һ���а�ɫ�������ɣ��ʴ�Ϊ��ȡ����Na2S2O5�������Թ��У���������ˮ�ܽ⣬�μ����ᣬ���ٵμ��Ȼ�����Һ���а�ɫ�������ɡ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A��B��C��D���ֽ������±���װ�ý���ʵ�顣
װ�� |
|
|
|
���� | ���۽���A�����ܽ� | C���������� | A����������� |
����ʵ������ش��������⣺
��1��װ�ü��и����ĵ缫��Ӧʽ��________________________________________��
��2��װ���ң�����·��ת��6.02��1022��e������C�����ӵ�����Ϊ ��
��3��װ�ñ�����Һ��pH________��������С�����䡱����
��4�����ֽ��������ǿ������˳����____________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
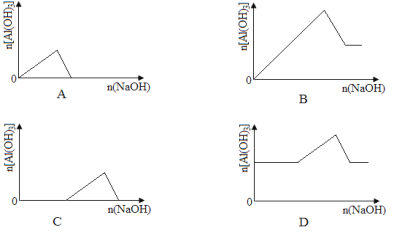
����Ŀ����֪�����£�Al(OH)3��Ksp���ܽ��Զ����Fe(OH)3����Ũ�Ⱦ�Ϊ0.1 mol��L-1��Fe(NO3)3��Al(NO3)3�����Һ�У���μ���NaOH��Һ������ʾ��ͼ��ʾ����Al(OH)3�����ʵ��������NaOH��Һ������Ĺ�ϵ����������( )
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʹʯ����Һ��죬����ʹƷ����Һ��Ϊ��ɫ�������ǣ� ��
A��NH3 B��HCl C��SO2 D��CO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ȷ�ӦX+Y=Z+W(Ex��EY��Ez��Ew�ֱ����X��Y��Z��W�����е�����)������˵��һ����ȷ���� �� ��
A��Ex��Ez+Ew
B��Ey��Ez+Ew
C��Ex+EY��Ez+Ew
D��Ex+Ey��Ez+Ew
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��B��C��D��E��F�������ڱ���ǰ�����ڵ�Ԫ�أ����ǵĺ˵���������������л�̬Aԭ�Ӽ۵����Ų�ʽΪnsnnpn+1��������B2EΪ���ӻ����Eԭ�Ӻ����M����ֻ�����ԳɶԵ��ӣ�CԪ���ǵؿ��к�����ߵĽ���Ԫ�أ�D���ʳ���������̫���ܵ�غͼ��ɵ�·оƬ��Fԭ��������������B����ͬ��������ڲ������������ӡ������������Ϣ���ش��������⣨������Ӧ��Ԫ�ط��ű�ʾ����
��1��A��B��E�ĵ�һ��������С�����˳��Ϊ ��
��2���⻯��A2H4������Aԭ�Ӳ�ȡ �ӻ���
��3����ԭ�ӵ���Χ�����Ų�������Ԫ��F�� ������̬Fԭ�ӵĵ����Ų�ʽΪ ��
��4��Ԫ��A��C���γ�һ�����ͻ�������ϣ��侧����кܸߵ�Ӳ�Ⱥ��۵㣬�仯�����������Ļ�ѧ������Ϊ ��
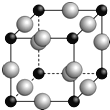
��5��A��F�γ�ij�ֻ�����ľ����ṹ����ͼ��ʾ������A����3�ۣ�ÿ�������ʾ1��ԭ�ӣ������仯ѧʽΪ ���谢���ӵ�����ΪNA���������������Fԭ�ӵĺ˼��Ϊa cm����þ������ܶ�Ϊ���ú�a��NA�Ĵ���ʽ��ʾ�� g/cm3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijԪ��������51��������27�����̬ԭ��δ�ɶԵ�����Ϊ(��
A. 3 B. 4 C. 5 D. 6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ�������ܱ������н��з�Ӧ��2SO2��g����O2��g��![]() 2SO3��g�� ��H��0�����и�ͼ��ʾ��������������ʱ���ı�ijһ������������Ӧ��Ӱ�죬���з�����ȷ���ǣ� ��
2SO3��g�� ��H��0�����и�ͼ��ʾ��������������ʱ���ı�ijһ������������Ӧ��Ӱ�죬���з�����ȷ���ǣ� ��

A. ͼ����ʾ�¶ȶԻ�ѧƽ���Ӱ�죬�Ҽ��¶Ƚϸ�
B. ͼ����ʾt0ʱ��ʹ�ô����Է�Ӧ���ʵ�Ӱ��
C. ͼ����ʾt0ʱ������O2��Ũ�ȶԷ�Ӧ���ʵ�Ӱ��
D. ͼ����a��b��c������ֻ��b���Ѿ��ﵽ��ѧƽ��״̬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����12�֣���ѧ����Cl2��FeCl2��KSCN�����Һ�ķ�Ӧ����ʵ��̽����
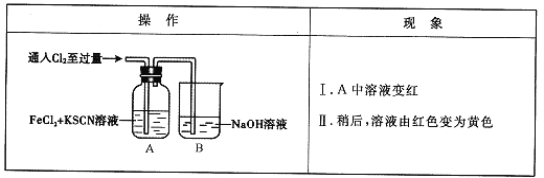
��1��B�з�Ӧ�����ӷ���ʽ��_ ___��
��2��A����Һ����ԭ����__ __��
��3��Ϊ��̽������II��ԭ��ͬѧ��������ʵ�顣
��ȡA�л�ɫ��Һ���Թ��У�����NaOH��Һ���к��ɫ�������ɣ�����Һ��һ������ ��
��ȡA�л�ɫ��Һ���Թ��У����������KSCN��Һ�����յõ���ɫ��Һ��
��ͬѧ��ʵ��֤��������������ԭ����SCN����Cl2�����˷�Ӧ��
��4����ͬѧ����SCN�����ܱ�Cl2�����ˣ����ֽ����������о���
������ʾ��SCN���ĵ���ʽΪ![]()
����ͬѧ��ΪSCN����̼Ԫ��û�б������������� ��
��ȡA�л�ɫ��Һ���Թ��У������������ữ��BaCl2��Һ��������ɫ�������ɴ�֤��SCN���б�������Ԫ���� ��
��ͨ��ʵ��֤����SCN���е�Ԫ��ת��ΪNO3����
����SCN����Cl2��Ӧ����1 mol CO2����ת�Ƶ��ӵ����ʵ����� mol��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com