
【题目】关于吸热反应X+Y=Z+W(Ex、EY、Ez、Ew分别代表X、Y、Z、W所具有的能量),以下说法一定正确的是 ( )
A.Ex<Ez+Ew
B.Ey>Ez+Ew
C.Ex+EY>Ez+Ew
D.Ex+Ey<Ez+Ew
 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
【题目】在一些茶叶的包装盒中有一个小袋,将小袋打开可看到灰黑色粉末,其中有的已变成棕褐色。将这种灰黑色粉末投入稀盐酸后,取其上层清液并加几滴氯水,再滴加KSCN溶液,马上出现红色。以下结论不正确的是 ( )
A.该灰黑色粉末作抗氧化剂
B.该灰黑色粉末不可食用
C.小袋中原来装有铁粉
D.小袋中原来装有氧化铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胃酸过多是常见的胃病。下面是甲、乙两种常见胃药的说明摘要。
甲:①白色结晶状粉末,可缓缓分解;
②能溶于水;
③遇酸及酸性药物则产生二氧化碳;
④胃酸患者过多服用多见胃胀气,甚至有引起胃溃疡穿孔的危险。
乙:①与胃酸作用是中和反应,作用缓慢而持久,可维持3~4小时。
②凝胶本身覆盖于溃疡面上,具有保护作用。
③可溶于稀酸或氢氧化钠溶液中。
(1)请你推测,甲中含有的主要化学成分是________(填化学式);乙中含有的主要化学成分是________(填化学式)。
(2)试写出甲中含有的主要化学成分引起胃胀气反应的离子方程式:____________________________。
(3)试写出乙中含有的主要化学成分溶于NaOH溶液的离子方程式:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可用自由电子与金属离子的碰撞中有能量传递来解释的物理性质是( )
A.金属是热的良导体
B.金属是电的良导体
C.金属有良好的延展性
D.有金属光泽,不透明
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O3)是常用的食品抗氧化剂之一,在空气中被氧化生成的产物为Na2SO4.某小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用下图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置II中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5
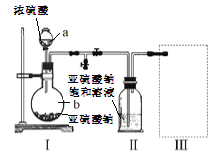
(1)仪器a、b的名称分别是_________、__________。
(2)装置I中产生气体的化学方程式为__________。
(3)要从装置II中获得已析出的晶体,可采用的分离方法是__________,该方法用到的玻璃仪器除烧杯、漏斗还需___________。
(4)装置III用于处理尾气,可选用的最合理装置(夹持仪器已略去)为_________(填序号)。
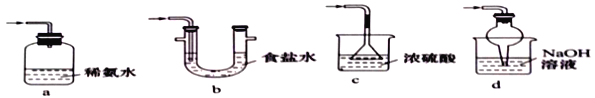
实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3
(5)NaHSO3溶液中HSO3-的电离程度大于水解程度,可采用的实验方法是_________(填序号)。
A.测定溶液的pH
B.加入Ba(OH)2溶液
C.加入盐酸
D.加入品红溶液
E.用蓝色石蕊试纸检测
(6)检验Na2S2O5晶体在空气中已被氧化的实验方案是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是( )
A.卤化氢中,以HF沸点最高,是由于HF分子间存在氢键
B.邻羟基苯甲醛的熔、沸点比对羟基苯甲醛的熔、沸点低
C.N2分子中有一个σ键,2个π键
D.在元素周期表中,s区,d区和ds区的元素都是金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)安对于工农业生产及国防等都具有重要意义。
(1)工业上以CO2和NH3为原料在一定条件下合成尿素的化学方程式为CO2(g)+2NH3(g) ![]() CO(NH2)2|(s)+H2O(g),随温度升高,尿素的产率降低。则该反应的△H____0(填“>”或“<”);若反应体系的容积为1L,某温度下通入1molCO2和2molNH3,2min时达到平衡,H2O(g)的物质的量为0.8mol,则0~2min时间段内反应速率v(NH3)=______mol/(L·min),该反应的平衡常数可表示为K=_______。
CO(NH2)2|(s)+H2O(g),随温度升高,尿素的产率降低。则该反应的△H____0(填“>”或“<”);若反应体系的容积为1L,某温度下通入1molCO2和2molNH3,2min时达到平衡,H2O(g)的物质的量为0.8mol,则0~2min时间段内反应速率v(NH3)=______mol/(L·min),该反应的平衡常数可表示为K=_______。
(2)合成氨的原料之一为氢气,以天然气为原料制备氢气的原理如下:
CH4(g)+H2O(g)=CO(g)+3H2(g) △H>0
下列措施一定能使平衡体系中氢气百分含量增大的是______
A.升高温度 B.增大水蒸气浓度 C.加入催化剂 D.减小压强
(3)T℃时,将1molCO和H2的混合气体与0.2molH2O(g)混合,发生反应CO(g)+H2O(g)![]() CO2(g)+H2(g) △H<0,得到1.18molCO、CO2和H2的混合气体,测得CO的转化率为90%,则原混合气体中CO和H2的体积比为_______,若容器的容积为2L,该温度下平衡常数K=_______。
CO2(g)+H2(g) △H<0,得到1.18molCO、CO2和H2的混合气体,测得CO的转化率为90%,则原混合气体中CO和H2的体积比为_______,若容器的容积为2L,该温度下平衡常数K=_______。
(4)在恒容密闭容器中发生反应CO(g)+H2O(g)![]() CO2(g)+H2(g) △H<0。已知c(H2)随反应时间t的变化如图甲中曲线I所示。若起始时容器的容积是上述密闭容器的1/2,其他条件不变,请在图甲中画出c(H2)随反应时间t的变化曲线II。
CO2(g)+H2(g) △H<0。已知c(H2)随反应时间t的变化如图甲中曲线I所示。若起始时容器的容积是上述密闭容器的1/2,其他条件不变,请在图甲中画出c(H2)随反应时间t的变化曲线II。

(5)图乙是在一定温度和压强下合成氨反应中H2和N2的起始物质的量之比与NH3平衡体积分数的关系。图中a点的横坐标为______;若按此网站的量之比投料,达到平衡时N2的体积分数为14.5%,则a点的纵坐标为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤的气化在煤化工业中占有重要地位,至今仍然是化学工业的重要组成部分。
(1)已知H2(g)、CO(g)和CH3OH(l)的燃烧热分别为-285.8 kJmol-1、-283.0 kJmol-1和-726.5 kJmol-1。请写出甲醇(CH3OH)不完全燃烧生成一氧化碳和液态水的热化学方程式:________。
(2)工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)![]() CH3OH(g) △H。下表所列数据是该反应在不同温度下的化学平衡常数(K)
CH3OH(g) △H。下表所列数据是该反应在不同温度下的化学平衡常数(K)
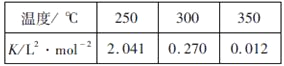
①由表中数据判断△H_______0(填“>”、“=”或“<”)
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,4min达到平衡时测得c(CO)=0.2mol/L,此时的温度为________,则反应速率v(H2)=__________。
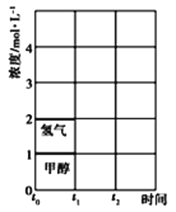
(3)T℃时,在t0时刻,合成甲醇反应CO(g)+2H2(g)![]() CH3OH(g)达到平衡,若在t1时刻将容器的体积缩小为原来的一半,在t2时刻又达到新的平衡,请在图中用曲线表示t1~t2时间段氢气、甲醇物质的量浓度随时间变化的趋势示意图_______(其他条件不变,曲线上必须标明氢气、甲醇)。
CH3OH(g)达到平衡,若在t1时刻将容器的体积缩小为原来的一半,在t2时刻又达到新的平衡,请在图中用曲线表示t1~t2时间段氢气、甲醇物质的量浓度随时间变化的趋势示意图_______(其他条件不变,曲线上必须标明氢气、甲醇)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com