
【题目】煤的气化在煤化工业中占有重要地位,至今仍然是化学工业的重要组成部分。
(1)已知H2(g)、CO(g)和CH3OH(l)的燃烧热分别为-285.8 kJmol-1、-283.0 kJmol-1和-726.5 kJmol-1。请写出甲醇(CH3OH)不完全燃烧生成一氧化碳和液态水的热化学方程式:________。
(2)工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)![]() CH3OH(g) △H。下表所列数据是该反应在不同温度下的化学平衡常数(K)
CH3OH(g) △H。下表所列数据是该反应在不同温度下的化学平衡常数(K)
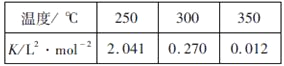
①由表中数据判断△H_______0(填“>”、“=”或“<”)
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,4min达到平衡时测得c(CO)=0.2mol/L,此时的温度为________,则反应速率v(H2)=__________。
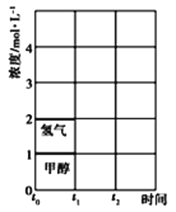
(3)T℃时,在t0时刻,合成甲醇反应CO(g)+2H2(g)![]() CH3OH(g)达到平衡,若在t1时刻将容器的体积缩小为原来的一半,在t2时刻又达到新的平衡,请在图中用曲线表示t1~t2时间段氢气、甲醇物质的量浓度随时间变化的趋势示意图_______(其他条件不变,曲线上必须标明氢气、甲醇)。
CH3OH(g)达到平衡,若在t1时刻将容器的体积缩小为原来的一半,在t2时刻又达到新的平衡,请在图中用曲线表示t1~t2时间段氢气、甲醇物质的量浓度随时间变化的趋势示意图_______(其他条件不变,曲线上必须标明氢气、甲醇)。
【答案】 CH3OH(l)+O2(g)=CO(g)+2H2O(l) △H=-443.5kJ/mol < 250℃ 0.4mol/(L·min) 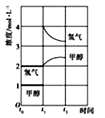
【解析】试题分析:(1)由CO(g)和CH3OH(l)的燃烧热△H分别为-283.0kJmol-1和-726.5kJmol-1,则
①CO(g)+1/2O2(g)=CO2(g)△H=-283.0kJmol-1
②CH3OH(l)+3/2O2(g)=CO2(g)+2 H2O(l)△H=-726.5kJmol-1
由盖斯定律可知用②-①得反应CH3OH(l)+O2(g)=CO(g)+2 H2O(l)的反应热△H=-726.5kJmol-1-(-283.0kJmol-1)=-443.5kJmol-1;
(2)①由表中数据可知随着温度的升高,平衡常数逐渐减小,这说明升高温度平衡向逆反应方向进行,因此正反应是放热反应,则△H<0;
② CO(g) + 2H2(g)![]() CH3OH (g)
CH3OH (g)
c(起始)mol/L 1 3 0
c(变化)mol/L 0.8 1.6 0.8
c(平衡)mol/L 0.2 1.4 0.8
则平衡常数K=![]()
所以此时的温度为250℃
反应速率v(H2)=1.6mol/L÷4min=0.4mol/(L·min)。
(3)T℃时,在t0时刻,合成甲醇反应CO(g)+2H2(g)![]() CH3OH(g)达到平衡,若在t1时刻将容器的体积缩小为原来的1/2,压强增大,平衡显正反应方向进行,所以t1~t2时间段氢气、甲醇物质的量浓度随时间变化的趋势示意图为(见答案)。
CH3OH(g)达到平衡,若在t1时刻将容器的体积缩小为原来的1/2,压强增大,平衡显正反应方向进行,所以t1~t2时间段氢气、甲醇物质的量浓度随时间变化的趋势示意图为(见答案)。


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:
【题目】关于吸热反应X+Y=Z+W(Ex、EY、Ez、Ew分别代表X、Y、Z、W所具有的能量),以下说法一定正确的是 ( )
A.Ex<Ez+Ew
B.Ey>Ez+Ew
C.Ex+EY>Ez+Ew
D.Ex+Ey<Ez+Ew
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中充入一定量N2和H2,在一定条件下发生反应:N2+3H2![]() 2NH3。下列说法错误的是
2NH3。下列说法错误的是
A.使用合适催化剂可以加快反应速率
B.升高温度可以增大反应速率
C.达到化学平衡时,N2、H2和NH3物质的量浓度一定相等
D.若反应在密闭容器中进行,N2和H2不可能100%转化为NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)在呼吸面具和潜水艇中可用过氧化钠作为供氧剂。请用如图实验装置,选用适当的化学试剂和实验用品,设计并完成对过氧化钠这一性质的探究。
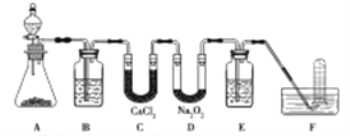
(1)A是实验室制取CO2的装置,其中发生反应的离子方程式是________;装置B的作用是____________。
(2)检验F中气体成分,即能说明过氧化钠可作潜水艇供氧剂,则实验操作的方法及现象是_______________。
(3)查阅有关资料表明:2H2O+2Na2O2=4NaOH+O2↑。某研究小组用同位素标记法对过氧化钠进行标记(![]() ),以探究这一反应的历程:_________________
),以探究这一反应的历程:_________________
①甲同学从电子转移角度得出其离子方程式为:_______________。
②乙同学发现:向Na2O2与水反应后的溶液中加入MnO2,又产生无色能使带火星的木条复燃的气体,从这个角度,写出其反应历程:___________________。
(4)设计并完成过氧化钠样品(已知所含杂质与酸碱均不反应)的纯度测定:
甲、乙两位同学各取了ag样品并分别配制成了100.00mL溶液进行实验,实验操作中甲同学是将样品直接溶于蒸馏水中;而乙同学却是将蒸馏水先加热煮沸,再把蒸馏水分成两份,一份中趁热加入样品溶解,待冷却到室温后再加人另一份水来进行配制。他们分别取出各自配制的溶液20.00mL,加入酚酞数滴后,用浓度为cmol/L的盐酸进行滴定;重复滴定操作2次,甲同学和乙同学分别计算出了所用盐酸的体积平均值,分别为VAmL和VWmL。
①在样品的溶解与配制中,你认为_______(填“甲”、“乙”)同学的操作是合理的,理由是:__________________。
②另一同学的操作将会使实验结果______(填“偏大”、“偏小”或“无影响”)。
③原过氧化钠样品的纯度是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)某探究小组以硫酸和铜为原料设计如下四种制备硫酸铜晶体的路线:

请回答下列有关问题:
(1)甲方案中第一步发生反应的化学方程式为___________________。
(2)甲、乙、丙方案中,_____方案更合理,原因是________________。
(3)采用乙方案,用废铜、废酸(含HNO3、H2SO4)为主要原料制备硫酸铜晶体,某含有c(HNO3)=2molL-1,c(H2SO4)=4molL-1的废酸混合液100mL(不使用其它酸或氧化剂),最多能制备硫酸铜晶体(CuSO4 5H2O)的质量为___________。
(4)丙方案中灼烧时,应在________中进行(填仪器名称),该实验中的后续操作指的是____________。
(5)丁方案中X可以是试剂,也可以是反应条件:
①若X为试剂,该反应的化学方程式为__________________。
②若X为反应条件,即通电,在虚线框中画出该实验设计图。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(12分)甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。
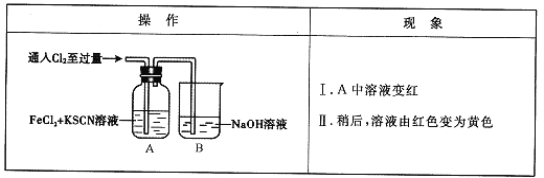
(1)B中反应的离子方程式是_ ___。
(2)A中溶液变红的原因是__ __。
(3)为了探究现象II的原因,甲同学进行如下实验。
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在 。
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液。
甲同学的实验证明产生现象Ⅱ的原因是SCN-与Cl2发生了反应。
(4)甲同学猜想SCN-可能被Cl2氧化了,他又进行了如下研究。
资料显示:SCN-的电子式为![]()
①甲同学认为SCN-中碳元素没有被氧化,理由是 。
②取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN—中被氧化的元素是 。
③通过实验证明了SCN-中氮元素转化为NO3-。
④若SCN-与Cl2反应生成1 mol CO2,则转移电子的物质的量是 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据钠与水(滴有酚酞溶液)反应的实验现象,不能得出的结论是 ( )
A. 钠的密度比水小 B. 钠的硬度小
C. 钠很活泼,易与水反应生成碱性物质 D. 钠的熔点低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:A是石油裂解气的主要成份,A的产量通常用来衡量一个国家的石油化工水平。现以A为主要原料合成乙酸乙酯,其合成路线如下图所示。
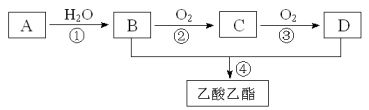
回答下列问题:
(1)写出A的电子式 ,其空间构型 。
(2)B、D分子中的官能团名称分别是 、 ;
(3)写出下列反应的反应类型:② ④ ;
(4)写出A→B反应的化学方程式: ;
(5)写出B与D反应生成乙酸乙酯的化学反应方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是MgSO4、NaCl的溶解度曲线。下列说法正确的是( )
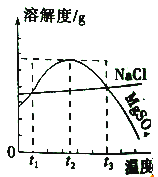
A.MgSO4的溶解度随温度升高而升高
B.NaCl的溶解度比MgSO4的溶解度大
C.在t2℃时,MgSO4饱和溶液的溶质质量分数最大
D.把MgSO4饱和溶液的温度从t3℃降至t2℃时,有晶体析出
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com