
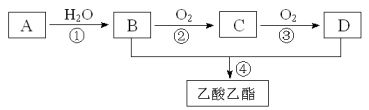
����Ŀ����֪��A��ʯ���ѽ�������Ҫ�ɷݣ�A�IJ���ͨ����������һ�����ҵ�ʯ�ͻ���ˮƽ������AΪ��Ҫԭ�Ϻϳ�������������ϳ�·������ͼ��ʾ��
�ش��������⣺
��1��д��A�ĵ���ʽ ����ռ乹�� ��
��2��B��D�����еĹ��������Ʒֱ��� �� ��
��3��д�����з�Ӧ�ķ�Ӧ���ͣ��� �� ��
��4��д��A��B��Ӧ�Ļ�ѧ����ʽ�� ��
��5��д��B��D��Ӧ�������������Ļ�ѧ��Ӧ����ʽ�� ��
���𰸡���1��![]() �� ƽ����
�� ƽ����
��2���ǻ����Ȼ� ��
��3��������ȡ��(����)��
��4��CH2=CH2��H2O��CH3CH2OH(����������) ��
��5��CH3CH 2OH��CH3COOH��CH3COOCH2CH3��H2O(������Ũ���ᣬ����)��
��������
������������������Ϣ�ƶ�AΪCH2=CH2��BΪCH3CH2OH��CΪCH3CHO��DΪCH3COOH��
��1��AΪCH2=CH2������ʽΪ![]() ����ռ乹��Ϊƽ������
����ռ乹��Ϊƽ������
��2��BΪCH3CH2OH��DΪCH3COOH�������еĹ��������Ʒֱ����ǻ����Ȼ���
��3����Ӧ�����Ҵ���������Ӧ������ȩ����Ӧ����Ϊ������Ӧ����Ӧ����������Ҵ���Ӧ��������������ˮ����Ӧ����Ϊȡ����Ӧ��������Ӧ��
��4����ϩ��ˮ�����ӳɷ�Ӧ�����Ҵ�����ѧ����ʽΪCH2=CH2��H2O![]() CH3CH2OH��
CH3CH2OH��
��5���Ҵ������ᷴӦ��������������ˮ����ѧ��Ӧ����ʽΪ
CH3CH 2OH��CH3COOH![]() CH3COOCH2CH3��H2O��
CH3COOCH2CH3��H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(14��)�����ڹ�ũҵ�����������ȶ�������Ҫ���塣
��1����ҵ����CO2��NH3Ϊԭ����һ�������ºϳ����صĻ�ѧ����ʽΪCO2(g)+2NH3(g) ![]() CO(NH2)2|(s)+H2O(g)�����¶����ߣ����صIJ��ʽ��͡���÷�Ӧ����H____0(����>������<��)������Ӧ��ϵ���ݻ�Ϊ1L��ij�¶���ͨ��1molCO2��2molNH3��2minʱ�ﵽƽ�⣬H2O(g)�����ʵ���Ϊ0.8mol����0��2minʱ����ڷ�Ӧ����v(NH3)=______mol/(L��min)���÷�Ӧ��ƽ�ⳣ���ɱ�ʾΪK=_______��
CO(NH2)2|(s)+H2O(g)�����¶����ߣ����صIJ��ʽ��͡���÷�Ӧ����H____0(����>������<��)������Ӧ��ϵ���ݻ�Ϊ1L��ij�¶���ͨ��1molCO2��2molNH3��2minʱ�ﵽƽ�⣬H2O(g)�����ʵ���Ϊ0.8mol����0��2minʱ����ڷ�Ӧ����v(NH3)=______mol/(L��min)���÷�Ӧ��ƽ�ⳣ���ɱ�ʾΪK=_______��
��2���ϳɰ���ԭ��֮һΪ����������Ȼ��Ϊԭ���Ʊ�������ԭ�����£�
CH4(g)+H2O(g)=CO(g)+3H2(g) ��H>0
���д�ʩһ����ʹƽ����ϵ�������ٷֺ����������______
A�������¶� B������ˮ����Ũ�� C��������� D����Сѹǿ
��3��T��ʱ����1molCO��H2�Ļ��������0.2molH2O(g)��ϣ�������ӦCO(g)+H2O(g)![]() CO2(g)+H2(g) ��H<0���õ�1.18molCO��CO2��H2�Ļ�����壬���CO��ת����Ϊ90%,��ԭ���������CO��H2�������Ϊ_______�����������ݻ�Ϊ2L�����¶���ƽ�ⳣ��K=_______��
CO2(g)+H2(g) ��H<0���õ�1.18molCO��CO2��H2�Ļ�����壬���CO��ת����Ϊ90%,��ԭ���������CO��H2�������Ϊ_______�����������ݻ�Ϊ2L�����¶���ƽ�ⳣ��K=_______��
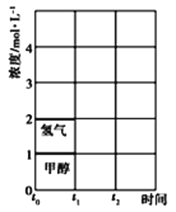
��4���ں����ܱ������з�����ӦCO(g)+H2O(g)![]() CO2(g)+H2(g) ��H<0����֪c(H2)�淴Ӧʱ��t�ı仯��ͼ��������I��ʾ������ʼʱ�������ݻ��������ܱ�������1/2,�����������䣬����ͼ���л���c(H2)�淴Ӧʱ��t�ı仯����II��
CO2(g)+H2(g) ��H<0����֪c(H2)�淴Ӧʱ��t�ı仯��ͼ��������I��ʾ������ʼʱ�������ݻ��������ܱ�������1/2,�����������䣬����ͼ���л���c(H2)�淴Ӧʱ��t�ı仯����II��

��5��ͼ������һ���¶Ⱥ�ѹǿ�ºϳɰ���Ӧ��H2��N2����ʼ���ʵ���֮����NH3ƽ����������Ĺ�ϵ��ͼ��a��ĺ�����Ϊ______����������վ����֮��Ͷ�ϣ��ﵽƽ��ʱN2���������Ϊ14.5%,��a���������Ϊ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ú��������ú����ҵ��ռ����Ҫ��λ��������Ȼ�ǻ�ѧ��ҵ����Ҫ��ɲ��֡�
��1����֪H2(g)��CO(g)��CH3OH(l)��ȼ���ȷֱ�Ϊ-285.8 kJmol-1��-283.0 kJmol-1��-726.5 kJmol-1����д���״�(CH3OH)����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽ��________��
��2����ҵ��һ���ں����ܱ������в������з�Ӧ�ϳɼ״���CO(g)+2H2(g)![]() CH3OH(g) ��H���±����������Ǹ÷�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����K)
CH3OH(g) ��H���±����������Ǹ÷�Ӧ�ڲ�ͬ�¶��µĻ�ѧƽ�ⳣ����K)
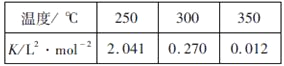
���ɱ��������ж���H_______0������>������=������<����
��ij�¶��£���2molCO��6molH2����2L���ܱ������У���ַ�Ӧ��4min�ﵽƽ��ʱ���c(CO)=0.2mol/L����ʱ���¶�Ϊ________����Ӧ����v(H2)=__________��
��3��T��ʱ����t0ʱ�̣��ϳɼ״���ӦCO(g)+2H2(g)![]() CH3OH(g)�ﵽƽ�⣬����t1ʱ�̽������������СΪԭ����һ�룬��t2ʱ���ִﵽ�µ�ƽ�⣬����ͼ�������߱�ʾt1��t2ʱ����������״����ʵ���Ũ����ʱ��仯������ʾ��ͼ_______�������������䣬�����ϱ�������������״�����
CH3OH(g)�ﵽƽ�⣬����t1ʱ�̽������������СΪԭ����һ�룬��t2ʱ���ִﵽ�µ�ƽ�⣬����ͼ�������߱�ʾt1��t2ʱ����������״����ʵ���Ũ����ʱ��仯������ʾ��ͼ_______�������������䣬�����ϱ�������������״�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���ҿ������Ҷ�����ͭ��ͭ�Ļ������Ʊ��Ҷ�ȩ����ͼ��ij��ȤС����Ƶ�ʵ��װ�ã��ұߵķ�Ӧװ����ͬ������ߵ����巢��װ�ò�ͬ���Թ�C��װ��ˮ(����װ��δ����)���Իش�
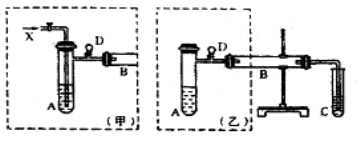
��1������װ���е�A��B��������ȣ�A����ˮԡ���ȣ�A����ˮԡ���ȵ���Ҫ�ŵ��� ��
��2��������װ�ý���ʵ�飬B�ܴ�װͭ�ۣ�ͨ��A�ܵ�����ΪX��B�з�Ӧ�Ļ�ѧ����ʽΪ ��
��3��������װ�ý���ʵ�飬��B����Ӧװ ��B�з�Ӧ�Ļ�ѧ����ʽΪ ��
��4��ʵ�����ʱ�ȴ�D�������У��ٳ�ȥ�ƾ��ƣ���������Ŀ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���ԭ�ӽṹ��Ԫ�����ʵ�˵����ȷ����
A. ���н���Ԫ�صĻ�������һ�������Ӽ�
B. VIIA��Ԫ�ص������ӻ�ԭ��Խǿ��������������Ӧˮ���������Խǿ
C. ͬ��Ԫ�ص�ԭ�Ӿ�����ͬ����������������
D. IA�����Ԫ����ͬ�����н�������ǿ��Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������泥�NH4OCN�����ȿ�ת��Ϊ�л�������[CO(NH2)2],��һ��Ӧ�ķ���ʹ����̤�����л��ϳɵ����̡����й������������ʵ�˵������ȷ����
A�����������
B�����������ӻ�����
C����Ϊͬ��������
D����Ϊͬ���칹��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��Ӧ����Ϊ�ɼ����Ѻ��¼��γɵĹ�������֪����P4O6�ķ��ӽṹ��ͼ��ʾ�����ṩ���»�ѧ���ļ��ܣ�kJ��mol-1 ���� P-P��198 P-O��360 O=O��498��������1 mol P4O6 �÷�ӦP4��������+3O2=P4O6�е������仯Ϊ

A������1638 kJ���� B���ų�1638 kJ����
C������126 kJ���� D���ų�126 kJ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��Zn��Cu�γɵ�ԭ��أ��ش��������⣺
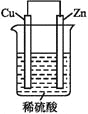
��1����������____��Ӧ��ѡ����������������ԭ�����������缫��ӦʽΪ��____��
��2��������������____�缫��ѡ����Cu������Zn�����������·��������һ�缫����������____�缫�����ƶ���ѡ����Cu������Zn������
��3����0.1 mol�����������ߣ������H2�ڱ�״���µ����Ϊ____�����ǶϿ�Zn��Cu֮��ĵ��ߣ��������ݵ��ٶ�____��ѡ�����ӿ���������������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪A��B��C��D��E�������ʣ���A��B��C��D����ɫ��Ӧ�ʻ�ɫ�����ǵĹ�ϵ����ͼ��ʾ����֪EΪ���嵥�ʣ���ʹ�����ǵ�ľ����ȼ��

��1��д���������ʵĻ�ѧʽ��A ��B C ��
D ��E ��
��2��д��A���ȷֽ�Ļ�ѧ����ʽ�� ��
��3��д��Y��C��Ӧ�����ӷ���ʽ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com