
【题目】(14分)砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途.回答下列问题:
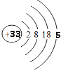
(1)画出砷的原子结构示意图 .
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫.写出发生反应的化学方程式 . 该反应需要在加压下进行,原因是 .
(3)已知:As(s)+ ![]() H2(g)+2O2(g)=H3AsO4(s)△H1
H2(g)+2O2(g)=H3AsO4(s)△H1
H2(g)+ ![]() O2(g)=H2O(l)△H2
O2(g)=H2O(l)△H2
2As(s)+ ![]() O2(g)=As2O5(s)△H3
O2(g)=As2O5(s)△H3
则反应As2O5(s)+3H2O(l)=2H3AsO4(s)的△H= .
(4)298K时,将20mL 3x molL﹣1 Na3AsO3、20mL 3x molL﹣1 I2和20mL NaOH溶液混合,发生反应:AsO33﹣(aq)+I2(aq)+2OH﹣AsO43﹣(aq)+2I﹣(aq)+H2O(l).溶液中c(AsO43﹣)与反应时间(t)的关系如图所示.
①下列可判断反应达到平衡的是(填标号).
a.溶液的pH不再变化
b.v(I﹣)=2v(AsO33﹣)
c.c (AsO43﹣)/c (AsO33﹣)不再变化
d.c(I﹣)=y molL﹣1
②tm时,v正 v逆(填“大于”“小于”或“等于”).
③tm时v逆tn时v逆(填“大于”“小于”或“等于”),理由是 .
④若平衡时溶液的pH=14,则该反应的平衡常数K为 .
【答案】
(1)
(2)2As2S3+5O2+6H2O=4H3AsO4+6S;加压反应速率增大,而且平衡右移,可提高生产效率
(3)2△H1﹣3△H2﹣△H3
(4)ac;大于;小于;tm时AsO43﹣浓度更小,反应速率更慢;![]()
【解析】解:(1)砷元素原子序数为33,原子核外有四个电子层,最外层5个电子,原子结构示意图为 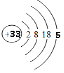 ,
,
所以答案是: 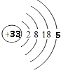 ;(2)工业上常将含砷废渣(主要成分为As2O3)制成浆状,通入O2氧化,生成H3AsO4和单质硫,砷元素化合价+3价变化为+5价,反应的化学方程式为2As2S3+5O2+6H2O=4H3AsO4+6S,增大压强,可增大反应速率,并使平衡正向移动,增大反应物的转化率,
;(2)工业上常将含砷废渣(主要成分为As2O3)制成浆状,通入O2氧化,生成H3AsO4和单质硫,砷元素化合价+3价变化为+5价,反应的化学方程式为2As2S3+5O2+6H2O=4H3AsO4+6S,增大压强,可增大反应速率,并使平衡正向移动,增大反应物的转化率,
所以答案是:2As2S3+5O2+6H2O=4H3AsO4+6S;加压反应速率增大,而且平衡右移,可提高生产效率;(3)已知:①As(s)+ ![]() H2(g)+2O2(g)=H3AsO4(s)△H1
H2(g)+2O2(g)=H3AsO4(s)△H1
②H2(g)+ ![]() O2(g)=H2O(l)△H2
O2(g)=H2O(l)△H2
③2As(s)+ ![]() O2(g)=As2O5(s)△H3
O2(g)=As2O5(s)△H3
则利用盖斯定律将①×2﹣②×3﹣③可得As2O5(s)+3H2O(l)=2H3AsO4(s)△H=2△H1﹣3△H2﹣△H3 ,
所以答案是:2△H1﹣3△H2﹣△H3;(4)①a.溶液pH不变时,则c(OH﹣)也保持不变,反应达到平衡状态,故a正确;
b.同一个化学反应,速率之比等于化学计量数之比,无论是否达到平衡,都存在v(I﹣)=2v(AsO33﹣),故b错误;
c.c (AsO43﹣)/c (AsO33﹣)不再变化,可说明各物质的浓度不再变化,反应达到平衡状态,故c正确;
d.由图可知,当c (AsO43﹣)=y molL﹣1时,浓度不再发生变化,则达到平衡状态,由方程式可知此时c(I﹣)=2y molL﹣1 , 所以c(I﹣)=y molL﹣1时没有达到平衡状态,故d错误.
所以答案是:ac;
②反应从正反应开始进行,tm时反应继续正向进行,则v正 大于 v逆 , 所以答案是:大于;
③tm时比tn时浓度更小,则逆反应速率更小,所以答案是:小于;tm时AsO43﹣浓度更小,反应速率更慢;
④反应前,三种溶液混合后,Na3AsO3的浓度为3xmol/L× ![]() =xmol/L,同理I2的浓度为xmol/L,反应达到平衡时,生产c(AsO43﹣)为ymol/L,则反应生产的c(I﹣)=2ymol/L,消耗的AsO33﹣、I2的浓度均为ymol/L,平衡时c(AsO33﹣)=(x﹣y)mol/L,c(I2)=(x﹣y)mol/L,溶液中c(OH﹣)=1mol/L,则K=
=xmol/L,同理I2的浓度为xmol/L,反应达到平衡时,生产c(AsO43﹣)为ymol/L,则反应生产的c(I﹣)=2ymol/L,消耗的AsO33﹣、I2的浓度均为ymol/L,平衡时c(AsO33﹣)=(x﹣y)mol/L,c(I2)=(x﹣y)mol/L,溶液中c(OH﹣)=1mol/L,则K= ![]() =
= ![]() ,
,
所以答案是: ![]() .
.
【考点精析】本题主要考查了化学平衡状态本质及特征的相关知识点,需要掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)才能正确解答此题.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】为体现节能减排的理念,中国研制出了新型固态氧化物燃料电池(SOFC),该电池的工作原理如图所示。下列说法正确的是( )
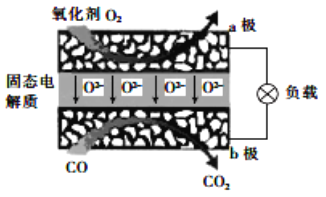
A. 正极的电极反应式为 O2+4e-+2H2O===4OH-
B. 还可以选用 NaOH 固体作固态电解质
C. 若反应中转移 1 mol 电子,则生成 22.4LCO2
D. 电子从 b 极经导线流向 a 极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不用其它试剂鉴别①CuSO4 ②Ba(OH)2 ③MgSO4 ④KNO3四种溶液,正确的鉴别顺序是( )
A.①②③④B.④①③②C.④②③①D.①③④②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是( )
A.向0.1mol?L﹣1 CH3COOH溶液中加入少量水,溶液中 ![]() 减小
减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中 ![]() 增大
增大
C.向盐酸中加入氨水至中性,溶液中 ![]() >1
>1
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3 , 溶液中 ![]() 不变
不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用H2还原WO3制备金属W的装置如图所示(Zn粒中往往含有碳等杂质,焦性没食子酸溶液用于吸收少量氧气),下列说法正确的是( )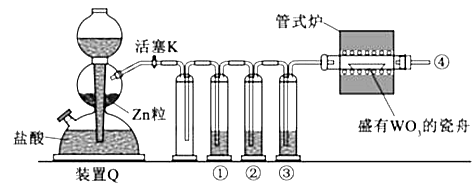
A.①、②、③中依次盛装KMNO4溶液、浓H2SO4、焦性没食子酸溶液
B.管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体浓度
C.结束反应时,先关闭活塞K,再停止加热
D.装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的离子方程式正确的是( )
A. 用小苏打治疗胃酸过多:![]() +H+===CO2↑+H2O
+H+===CO2↑+H2O
B. 往碳酸镁中滴加稀盐酸:![]() +2H+===CO2↑+H2O
+2H+===CO2↑+H2O
C. 往氨水中滴加氯化铝溶液:Al3++4OH﹣===![]() +2H2O
+2H2O
D. 氢氧化钡溶液与稀硫酸反应:Ba2++![]() +H++OH﹣===BaSO4↓+H2O
+H++OH﹣===BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式书写完全正确的是
A. H2SO4=H++SO42- B. Ca(OH)2=Ca2++(OH)22-
C. NaCl=Na++Cl- D. Al2(SO4)3=Al23++3SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的性质和用途的说法中,不正确的是( )
A | B | C | D |
氧化铁
| 带玻璃塞的试剂瓶
| 铁罐车
| 铝制饭盒
|
可用作红色颜料 | 可用于盛放 氢氧化钠溶液 | 可用于运输浓硫酸 | 不宜长时间存放酸性或碱性的食物 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验探究:探究碳、硅元素的非金属性的相对强弱。根据要求完成 下列各小题。
(1)实验装置:

填写所示仪器名称 A_________B________________________
(2)实验步骤:
连接仪器、_____________、加药品后,打开 a、然后滴入浓硫酸,加热
(3)问题探究:(已知酸性强弱:亚硫酸 >碳酸)
①铜与浓硫酸反应的化学方程式是________________________________;装置E中足量酸性KMnO4溶液的作用是_____________________________;
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是____________________________;
③依据试管 D 中的实验现象,能否证明硫元素的非金属性强于碳元素的非金属性___(填 “能”或“否”),试管 D 中发生反应的离子方程式是______________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com