
酒后驾车已成为一个社会问题。检测驾驶人员呼气中酒精浓度(BrAC)的方法有多种。
(1)早期是利用检测试剂颜色变化定性判断BrAC,曾用如下反应检测BrAC:
3CH3CH2OH+2KMnO4→3CH3CHO+2MnO2+2KOH+2H2O 。
上述反应中发生还原反应的过程是________ →_________。
(2)受上述方法启发,后来用五氧化二碘的淀粉溶液检测BrAC,溶液变蓝,乙醇被氧化为乙醛。该反应的化学方程式为_________。
(3)1994年美国首次批准使用唾液酒精含量检测方法,成为血液、呼气之后的第三种检测手段。其原理是在乙醇氧化酶作用下,乙醇与氧气反应生成乙醛和过氧化氢,判断该条件下乙醇、氧气、乙醛和过氧化氢四种物质中氧化性最强的物质是_______(填写化学式)。
科目:高中化学 来源: 题型:填空题
铜及其化合物在生产、生活中有广泛的应用。
(1)铜可采用如下方法制备:
火法炼铜:Cu2S+O2 2Cu+SO2
2Cu+SO2
湿法炼铜:CuSO4+Fe=FeSO4+Cu
上述两种方法中,铜元素均被__________ (填“氧化”还是“还原”)成铜单质。
(2)印刷电路板上使用的铜需要回收利用。
用FeCl3溶液浸泡印刷电路板制备CuCl2·2H2O,实验室模拟回收过程如下:
①步骤1中反应的离子方程式是_______________。
②步骤2所加的氧化剂最适宜的是____________________。
A.HNO3 B.H2O2 C.KMnO4
③步骤3的目的是使溶液的pH升高到5,此时Fe3+浓度为__________
[Ksp(Fe(OH)3)=4×10-38],可选用的“试剂1”是__________(写出一种即可)。
④蒸发浓缩CuCl2溶液时,要滴加浓盐酸,目的是_______________________ (用化学方程式并结合简要的文字说明),再经冷却、结晶、过滤,得到CuCl2·2H2O。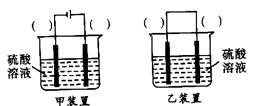
(3)欲实现反应Cu+H2SO4(aq)=CuSO4+H2↑,在你认为能实现该转化的装置中的括号内,标出电极材料(填“Cu”或“C”)。并写出电极反应式。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
根据反应3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O 回答下列问题:
(1)氧化剂是 ,氧化产物是 。
(2)氧化剂与氧化产物的物质的量比是 。
(3)当有2 mol HNO3被还原时,被氧化的物质的质量为 ,反应中转移的电子数为 ;
(4)有下列6种物质:K2SO4、K2SO3、I2、H2SO4、KIO3、H2O组成一个氧化还原反应,已知在反应中K2SO3失去电子。请回答下列问题:
将这6种物质分别填入下面对应的横线上,组成一个化学方程式(不需配平):
________+________+________ → ________+________+________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知33As、35Br位于同一周期。某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是 。已知0.2mol KBrO3在反应中得到1mol电子生成X,则X的化学式是 。
(2)在该反应条件下可推知 (填序号)。
a.氧化性:KBrO3>H3AsO4 b.氧化性:H3AsO4>KBrO3
c.还原性:AsH3>X d.还原性:X>AsH3
(3)该反应的氧化剂和还原剂的物质的量之比为__________; KBrO3与HBr反应也会生成X,则该反应中氧化剂和还原剂的物质的量之比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
实验室模拟用工业废弃固体(含有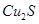 、Al2O3、Fe2O3、SiO2等)制取粗铜、绿矾(
、Al2O3、Fe2O3、SiO2等)制取粗铜、绿矾(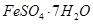 )和明矾[Kal(SO4)2
)和明矾[Kal(SO4)2 12H2O]的操作流程如下:
12H2O]的操作流程如下: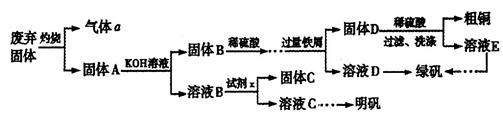
(1)试剂x是_________(写化学式)。
(2)配平下列方程式:
____
(4)为了分析产品(绿矾)中铁元素的含量,某同学称取20.0g样品配成100mL溶液,移取25.00mL用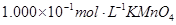 标准溶液进行滴定(MnO
标准溶液进行滴定(MnO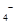 被还原为
被还原为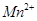 )。
)。
请回答下列问题:
①滴定时,KmnO4标准溶液应盛放在______________(填仪器名称)中。
②若达到滴定终点消耗KmnO4标准溶液体积为25.00mL,则该产品中铁元素的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)己知KBrO3在反应中得到电子,则该反应的还原剂是_____________。
(2)已知0.2mol KBrO3在反应中得到1 mol电子生成X,则X的化学式为_____________。
(3)将氧化剂和还原剂的化学式及其配平后的系数填入下列方框中,井标出电子转移的方向和数目: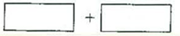
(4)溶液的酸碱性对氧化还原反应的方向有密切的关系。对于反应:AsO33-+I2+2OH- AsO43-+2I-+ 2H2O,在较强酸性时,上述氧化还原反应向____进行(填:“正反应”或“逆反应”);强碱性时,是否有利H3As3还原I2?为什么?_______________________________________。
AsO43-+2I-+ 2H2O,在较强酸性时,上述氧化还原反应向____进行(填:“正反应”或“逆反应”);强碱性时,是否有利H3As3还原I2?为什么?_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
铝热反应不仅用于焊接钢轨,而且还常用于冶炼熔点较高的金属如钒、铬、锰等。
请配平下列用铝热反应冶炼金属钒和钴的化学方程式,指出哪些物质是还原剂、哪些物质是氧化剂,并计算生成1 mol各种金属分别需要纯铝的质量。
V2O5+Al——Al2O3+V Co3O4+Al——Al2O3+Co
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:高温下使软锰矿与过量KOH(s)和KClO3(s)反应,生成K2MnO4(锰酸钾)和KCl;用水溶解,滤去残渣;酸化滤液,K2MnO4转化为MnO2和KMnO4;再滤去沉淀MnO2,浓缩结晶得到KMnO4晶体。
请回答:
(1)用软锰矿制备K2MnO4的化学方程式是 。
(2)K2MnO4转化为KMnO4的反应中氧化剂和还原剂的物质的量之比为 。生成0.1mol还原产物时转移电子 个。KMnO4、K2MnO4和MnO2的氧化性由强到弱的顺序是 。
(3)KMnO4能与热的Na2C2O4(aq,硫酸酸化)反应生成Mn2+和CO2。若取用软锰矿制得的KMnO4产品0.165g,能与0.335g Na2C2O4恰好完全反应(假设杂质均不能参与反应),该产品中KMnO4的纯度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某小组同学为探究H2O2、H2SO3、Br2氧化性强弱,设计如下实验(夹持仪器已略去,装置的气密性已检验)。
实验记录如下:
| | 实验操作 | 实验现象 |
| I | 打开活塞a,滴加氯水,关闭活塞a | A中溶液变为红棕色。 |
| II | 吹入热空气 | A中红棕色明显变浅;B中有气泡,产生大量白色沉淀,混合液颜色无明显变化。 |
| III | 停止吹入空气,打开活塞b,逐滴加入H2O2溶液 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色。 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com