
【题目】镧系为元素周期表中第ⅢB族、原子序数为57~71的元素。
(1)镝(Dy)的基态原子电子排布式为[Xe]4f106s2,画出镝(Dy)原子外围电子排布图:___________。
(2)高温超导材料镧钡铜氧化物中含有Cu3+,基态时Cu3+ 的电子排布式为________________。
(3)观察下面四种镧系元素的电离能数据,判断最有可能显示+3 价的元素是___________(填元素名称)。几种镧系元素的电离能(单位:kJ mol-1)
元素 | I1 | I2 | I3 | I4 |
Yb(镱) | 604 | 1217 | 4494 | 5014 |
Lu(镥) | 532 | 1390 | 4111 | 4987 |
La(镧) | 538 | 1067 | 1850 | 5419 |
Ce(铈) | 527 | 1047 | 1949 | 3547 |
(4)元素铕(Eu)可以形成配合物[Eu(NH3)2(H2O)2]Cl2。
①配合物的中心原子的配位数为_____,配体分子具有相同的___________(从给出选项中用序号表示)。
a.分子的立体构型 b.VSEPR构型 c.键角
d.孤电子对数 e.中心原子的价层电子对数
②写出氮的最简单气态氢化物水溶液中存在的氢键:__________________(任写一种)。
③元素Al 也有类似成键情况,气态氯化铝分子表示为(AlCl3)2,分子中Al 原子杂化方式为_____________,分子中所含化学键类型有______________(填字母)。
a.离子键 b.极性键 C.非极性键 d.配位键
(5)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中镨原子位于面心和顶点,则PrO2的晶胞中有________个氧原子;已知晶胞参数为a pm,密度为ρ g· cm-3,Mr(Pr O2) =173,则NA=_____________(用含a、ρ的代数式表示)。
【答案】.![]() [Ar]3d8 (或1s22s22p63s23p63d8)镧4b eN-H…O(或 N-H…N或O-H…N或O-H…O)sp3bd8
[Ar]3d8 (或1s22s22p63s23p63d8)镧4b eN-H…O(或 N-H…N或O-H…N或O-H…O)sp3bd8![]() (或
(或![]() )mol-1
)mol-1
【解析】
(1)根据镝(Dy)的基态原子电子排布式[Xe]4f106s2可知,镝(Dy)原子外围4f能级上有10个电子,6s能级上有2个电子,则其外围电子排布图为:![]() ;综上所述,本题答案是:
;综上所述,本题答案是:![]() 。
。
(2)Cu是29号元素,基态原子的电子排布式为:[Ar]3d104s1,高温超导材料镧钡铜氧化物中含有Cu3+,说明Cu失去3个电子,则基态时Cu3+的电子排布式为:[Ar]3d8(或1s22s22p63s23p63d8);综上所述,本题答案是:[Ar]3d8 (或1s22s22p63s23p63d8)。
(3)第三电离能与第一电离能、第二电离能相差越小,第三个电子越容易失去,+3价可能性越大,在上述表中,镧的I1、I2和I3最接近,则最有可能显示+3价的元素是镧;综上所述,本题答案是:镧。
(4)①配合物[Eu(NH3)2(H2O)2]Cl2结构中可知,Eu与2个NH3、2个H2O形成4个配位键,因此该配合物的中心原子的配位数为4;氨气分子中价层电子对个数=σ键个数+孤电子对个数=3+1/2(5-3×1)=4,因此N采取sp3杂化,VSEPR构型为四面体形;水分子中价层电子对个数=σ键个数+孤电子对个数=2+1/2(6-2×1)=4, 因此O采取sp3杂化,VSEPR构型为四面体形;选项b e符合题意;综上所述,本题答案是:4,b e。
②N和O元素的电负性强,则NH3的水溶液中存在的氢键有:N-H…O(或N-H…N或O-H…N或O-H…O);综上所述,本题答案是: N-H…O(或N-H…N或O-H…N或O-H…O)。
③在气态氯化铝(AlCl3)2中,每个Al原子与4个Cl原子形成4个σ键,则Al原子的杂化方式为sp3,在该分子中,与Al原子形成极性共价键的两个Cl原子中,有一个是配位键,氯原子提供电子,铝原子提供空轨道;气态氯化铝(AlCl3)2分子中所含化学键类型有:极性键,配位键;综上所述,本题答案是:sp3;bd。
(5)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中镨原子位于面心和顶点,所以晶胞中镨原子的个数为:6×1/2+8×1/8=4,则氧原子个数为:4×2=8;根据上述分析可知,一个二氧化镨晶胞中含有4个PrO2,则ρ=n×M/V=[(4/NA)×173]/(a×10-10)3,则NA=4×173/ρ×((a×10-10)3或(6.92×1032/ρa3) mol-1;综上所述,本题答案是:8; 4×173/ρ×((a×10-10)3或(6.92×1032/ρa3) mol-1。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 水的电离方程式:H2O = H++ OH-
B. pH=7的溶液一定是中性溶液
C. 升高温度,水的电离程度增大
D. 将稀醋酸加水稀释时,c(H+)减小,c(OH-)也减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将足量的CO2不断通入NaOH、Ba(OH)2、NaAlO2的混合溶液中〔已知NaAlO2与CO2反应生成Al(OH)3〕,则生成沉淀的物质的量与通入CO2的体积的关系可表示为( )
A.  B.
B. 
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若N60与C60结构相似的另一种“足球分子”,则下列说法正确的是
A. N60分子中只含有共价键 B. N60和14N都是氮的同位素
C. N60是一种新型化合物 D. N60与C60互为同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得氢气,具体流程如下:下列说法正确的是( )
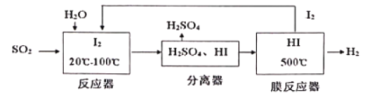
A. 分离器中的物质分离操作为过滤
B. 该工艺中HI的量没有改变,可视作该工艺的催化剂
C. 该工艺中I2和HI的相互转化体现了“碘循环”
D. 碘循环工艺的总反应为2SO2+4H2O+I2=H2+2H2SO4+2HI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把铁片放入盛有过量稀硫酸的试管中,不影响氢气产生速率的因素是( )
A. 硫酸的浓度B. 铁片的表面积
C. 溶液的温度D. 加少量Na2SO4固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)设NA代表阿伏加德罗常数的值。下列说法正确的是( )
A. 1 mol甲苯含碳碳双键的数目为3NA
B. 56 g纯铁粉与稀硝酸反应生成NO的分子数为NA
C. 25 ℃,1 L pH=13的氢氧化钡溶液中含OH-的数目为0.2NA
D. 标准状况下,11.2 L一氯甲烷含共价键的数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C在周期表中的位置如下图所示,其中B、C元素的原子序数之和是A元素原子序数的4倍,则A、B、C是
A | ||
B | C |
A. B、Mg、Si B. Be、Na、Al C. O、P、Cl D. C、Al、P
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化硫是一种强氧化剂,熔点为16.8℃,沸点为44.8℃,在50℃可升华,某合作学习小组的同学设计实验制备少量SO3.回答下列问题:
(1)甲组同学用图(a)所示装置制备少量SO3
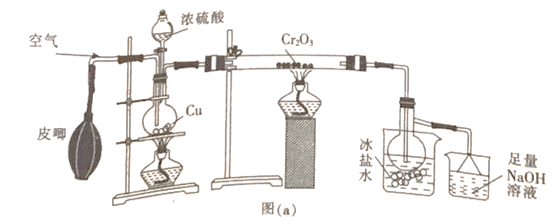
①盛有冰盐水烧杯的作用是_____________________。
②烧瓶中发生反应的化学方程式为_______________;烧杯中最后所含的盐为______(填化学式)。
(2)乙组同学用图(b)装置制备少量SO3,反应原理为2NO2+4SO2=4SO3+N2
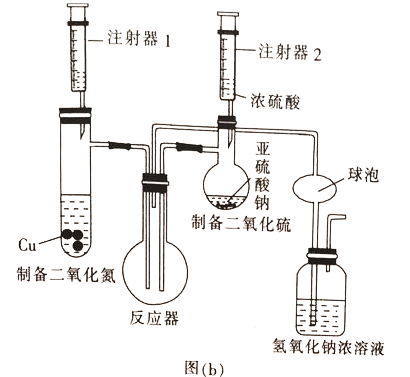
①装入药品后检验该装置气密性的方法是________________________。
②球泡的作用是___________,实验过程中反应器中观察到的现象是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com