
【题目】三氧化硫是一种强氧化剂,熔点为16.8℃,沸点为44.8℃,在50℃可升华,某合作学习小组的同学设计实验制备少量SO3.回答下列问题:
(1)甲组同学用图(a)所示装置制备少量SO3
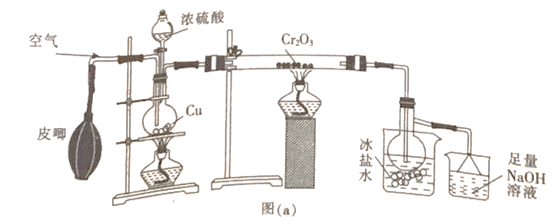
①盛有冰盐水烧杯的作用是_____________________。
②烧瓶中发生反应的化学方程式为_______________;烧杯中最后所含的盐为______(填化学式)。
(2)乙组同学用图(b)装置制备少量SO3,反应原理为2NO2+4SO2=4SO3+N2
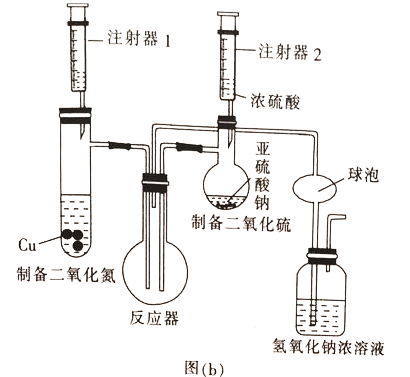
①装入药品后检验该装置气密性的方法是________________________。
②球泡的作用是___________,实验过程中反应器中观察到的现象是_______________。
【答案】将SO2蒸气冷却为固体Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2ONa2SO3(或Na2SO3和Na2SO4)将反应器微热,广口瓶导管口有气泡逸出,停止加热,液体上升形成一段液柱防止倒吸红棕色气体逐渐消失并产生白雾
CuSO4+SO2↑+2H2ONa2SO3(或Na2SO3和Na2SO4)将反应器微热,广口瓶导管口有气泡逸出,停止加热,液体上升形成一段液柱防止倒吸红棕色气体逐渐消失并产生白雾
【解析】
(1)①因为三氧化硫熔点为16.8℃,沸点为44.8℃,在50℃可升华,所以盛有冰盐水烧杯的作用是将SO2蒸气冷却为固体。
②烧瓶中发生的反应是浓硫酸和铜的反应,其化学方程式为Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;烧杯中的氢氧化钠作用是吸收没反应的二氧化硫气体,是SO2+2NaOH= Na2SO3+H2O ,Na2SO3不稳定易被氧化。 所以烧杯中最后所含的盐为Na2SO3或者Na2SO3和Na2SO4)。
CuSO4+SO2↑+2H2O;烧杯中的氢氧化钠作用是吸收没反应的二氧化硫气体,是SO2+2NaOH= Na2SO3+H2O ,Na2SO3不稳定易被氧化。 所以烧杯中最后所含的盐为Na2SO3或者Na2SO3和Na2SO4)。
(2)①装入药品后检验该装置气密性的方法是:将反应器微热,广口瓶导管口有气泡逸出,停止加热,液体上升形成一段液柱。
②因为二氧化硫易和氢氧化钠反应,SO2+2NaOH= Na2SO3+H2O 所以球泡的作用是防止倒吸,实验过程中反应器中二氧化氮和二氧化硫反应2NO2+4SO2=4SO3+N2,三氧化硫在50℃可升华,所以观察到的现象是红棕色气体逐渐消失并产生白雾。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】镧系为元素周期表中第ⅢB族、原子序数为57~71的元素。
(1)镝(Dy)的基态原子电子排布式为[Xe]4f106s2,画出镝(Dy)原子外围电子排布图:___________。
(2)高温超导材料镧钡铜氧化物中含有Cu3+,基态时Cu3+ 的电子排布式为________________。
(3)观察下面四种镧系元素的电离能数据,判断最有可能显示+3 价的元素是___________(填元素名称)。几种镧系元素的电离能(单位:kJ mol-1)
元素 | I1 | I2 | I3 | I4 |
Yb(镱) | 604 | 1217 | 4494 | 5014 |
Lu(镥) | 532 | 1390 | 4111 | 4987 |
La(镧) | 538 | 1067 | 1850 | 5419 |
Ce(铈) | 527 | 1047 | 1949 | 3547 |
(4)元素铕(Eu)可以形成配合物[Eu(NH3)2(H2O)2]Cl2。
①配合物的中心原子的配位数为_____,配体分子具有相同的___________(从给出选项中用序号表示)。
a.分子的立体构型 b.VSEPR构型 c.键角
d.孤电子对数 e.中心原子的价层电子对数
②写出氮的最简单气态氢化物水溶液中存在的氢键:__________________(任写一种)。
③元素Al 也有类似成键情况,气态氯化铝分子表示为(AlCl3)2,分子中Al 原子杂化方式为_____________,分子中所含化学键类型有______________(填字母)。
a.离子键 b.极性键 C.非极性键 d.配位键
(5)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中镨原子位于面心和顶点,则PrO2的晶胞中有________个氧原子;已知晶胞参数为a pm,密度为ρ g· cm-3,Mr(Pr O2) =173,则NA=_____________(用含a、ρ的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是
A. 0.1 mol NH4 F中含有的质子数为2NA
B. 1LpH=12的Na2CO3溶液中含Na+的数目为0.01NA
C. 2.24L(标准状况)Cl2溶于水,生成H+的数目为0.1NA
D. 含6.08乙酸的水溶液中氧原子的数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用镁还原硝基苯制取反式偶氮苯的化学方程式为:2![]() +4Mg+8CH3OH→
+4Mg+8CH3OH→![]() +4Mg(OCH3)2+4H2O
+4Mg(OCH3)2+4H2O
已知:①Mg(OCH3)2在水中极易水解。
②反式偶氮苯产品在紫外线照射后部分转化为顺式偶氮苯。
③反式(顺式)偶氮苯橙红色晶体,溶于乙醇、乙醚和醋酸,不溶于水。遇明火、高热可燃,受高热分解放出有毒的气体。
主要实验装置和步骤如下:
(I)合成:在反应器中加入一定量的硝基苯、甲醇和一小粒碘,加入少量镁粉,立即发生反应;等大部分镁粉反应完全后,再加入镁粉,反应继续进行,等镁粉完全反应后,加热回流30 min。
(II)分离与提纯:
①将所得液体趁热倒入烧杯的冰水中,并不断搅拌,用冰醋酸小心中和至pH为4~5,析出橙红色固体,过滤,用少量冰水洗涤。
②用95%的乙醇重结晶。回答下列问题:
(1)如图加热回流装置中,仪器a的名称是________,进水口为________(填1或2)

(2)若将镁粉一次性加入已装硝基苯、甲醇混合液的三颈瓶中,可能导致_________________。
A.反应太剧烈 B.液体太多搅不动 C.反应变缓慢 D.副产物增多
(3)分离与提纯:

①析出橙红色固体,过滤,用少量冰水洗涤中用冰水洗涤的原因是________________。
②为了得到较大颗粒的晶体,加入冰醋酸时需要________(填“缓慢加入”、“快速加入”)。
③烧杯中的反式偶氮苯转入布氏漏斗时,杯壁上往往还粘有少量晶体,需选用液体将杯壁上的晶体冲洗下来后转入布氏漏斗,下列液体最合适的是_______。
A.冰水 B.饱和NaCl溶液
C.95%乙醇水溶液 D.滤液
④抽滤完毕,应先断开________________________,以防倒吸。
⑤重结晶操作包括“加热溶解、趁热过滤、冷却结晶、抽滤、洗涤、干燥”。上述重结晶过程中的________操作除去了不溶性杂质。
(4)取0.1 g偶氮苯,溶于5 mL左右的苯中,将溶液分成两等份,分别装于两个试管中,其中一个试管用黑纸包好放在阴暗处,另一个则放在阳光下照射。用毛细管各取上述两试管中的溶液点在距离滤纸条末端1 cm处,再将滤纸条末端浸入装有1∶3的苯环己烷溶液的容器中,实验操作及现象如下图所示:


①实验中分离物质所采用的方法是________法。
②薄层色谱分析中,极性弱的物质,在溶剂中扩散更快。某同学采用薄层色谱分析所得偶氮苯,实验开始时和展开后的斑点如图所示,则反式偶氮苯比顺式偶氮苯的分子极性________________(填“强”或“弱”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁的化合物如Fe(OH)2、K2FeO4等在生产、生活中有重要作用。
(1)某学生用下列两种方法(如图)制备白色沉淀Fe(OH)2。方法1中加入维生素C的目的是_________________________________;方法2为了制得Fe(OH)2白色沉淀,在锥形瓶A和锥形瓶B中加入试剂后,打开止水夹C一段时间,再关闭止水夹C,关闭止水夹C的目的是_____________________________________________。

(2)实验室用氧化锌矿粉(主要成分为2ZnO、FeCO3)制备碱式碳酸锌[Zn(OH)2CO3],矿粉经“稀H2SO4溶解、H2O2氧化、调节pH"三步将矿粉中的Fe元素转化为沉淀而除去
不能用稀HNO3代替稀H2SO4溶解的理由是_______________________________。
(3)高铁酸钾(K2FeO4)是一种高效水处理剂,易溶于水,在强碱性条件下比较稳定,通常可用NaClO溶液与Fe(NO3)3溶液反应制得

①制备Na2 FeO4的化学方程式为________________________。
②能析出K2FeO4的原因是_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表为周期表中短周期的一部分,若X原子的最外层电子数是Y原子内层电子总数的![]() ,则下列说法不正确的是
,则下列说法不正确的是![]()
![]()
W |
|
|
|
| X | Y | Z |
A. Y的最高价氧化物的水化物的酸性比X的强 B. W、Z组成的某化合物是一种常见的溶剂
C. 原子半径大小比较:![]() D. W形成的氢化物种类很多
D. W形成的氢化物种类很多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,A是制取溴苯的实验装置,B、C是改进后的装置。请仔细分析,对比三个装置,回答下列问题:


(1)写出三个装置中发生反应的主要化学方程式:________________。写出B中右边试管中所发生反应的化学方程式:__________________。
(2)装置A和C均采用了长玻璃导管,其作用是_______、____________。
(3)在实验B、C装好仪器及药品后要使反应开始,应对装置B进行的操作是________________;应对装置C进行的操作是_______________________。
(4)装置B、C较好地解决了A中加装药品和使装置及时密封的矛盾,方便了操作。A装置中这一问题在实验中造成的后果是_________________。
(5)B中采用了洗气瓶吸收装置,其作用是______________________,反应后洗气瓶中可能出现的现象是_______________。
(6)B装置也存在两个明显的缺点,使实验的效果不好或不能正常进行。这两个缺点是_____________________;_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的叙述,正确的是( )
A. 加浓溴水,然后过滤,可除去苯中混有的少量乙烯
B. 苯、溴水和铁粉混合可制成溴苯
C. 氨基酸属于高分子化合物
D. 已知甲苯苯环上的二氯取代物有6种,则甲苯苯环上的三氯取代物也有6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四种有机化合物均含有多个官能团,其结构简式如下所示,下面有关说法中正确的是

A. A属于酚类,可与NaHCO3溶液反应产生CO2
B. B属于酚类,能使FeCl3溶液显紫色
C. 1molC最多能与3molBr2发生苯环上取代反应
D. D属于醇类,可以发生消去反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com