
【题目】已知![]() 将硫酸铵完全分解后的气体通入过量
将硫酸铵完全分解后的气体通入过量![]() 溶液中,有白色沉淀生成且有无色无味气体逸出。说法正确的是
溶液中,有白色沉淀生成且有无色无味气体逸出。说法正确的是![]()
A.生成沉淀中有![]() 和
和![]() ,且
,且![]() :
:![]() 约为1:1
约为1:1
B.生成沉淀中有![]() 和
和![]() ,且
,且![]() :
:![]() 约为1:2
约为1:2
C.生成沉淀中有![]() 和
和![]() ,且
,且![]() :
:![]() 约为1:3
约为1:3
D.从溶液中逸出的气体只有![]() ,溶液中溶质只有
,溶液中溶质只有![]() 、
、![]()
 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】用无机矿物资源生产部分材料,其生产流程如图.下列有关说法不正确的是![]()
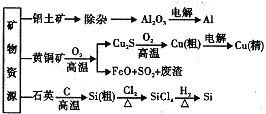
A.![]() 、
、![]() 均为共价化合物
均为共价化合物
B.生产过程中均涉及氧化还原反应
C.石英可用于制光导纤维,晶体Si常用做半导体材料
D.黄铜矿冶炼铜时产生的![]() 可用于生产硫酸,FeO可用于冶炼铁
可用于生产硫酸,FeO可用于冶炼铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上,煤的气化和液化是高效、清洁、综合利用煤炭的重要途径。
(1)一定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器发生反应:C(s)+2H2O(g)![]() CO2(g)+2H2(g) ΔH1>0,相关数据如下表:
CO2(g)+2H2(g) ΔH1>0,相关数据如下表:
容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | |
C(s) | H2O(g) | H2(g) | |||
甲 | 2 | T1 | 3 | 4 | 3.2 |
乙 | 1 | T2 | 1.5 | 2 | 1.2 |
①T1___T2(填“>、<或=”)。
②T1时达到平衡后再加入1molH2O(g),达到新平衡后H2(g)的物质的量分数___(填“增大”“不变”或“减小”);T2时,若起始时乙容器中加入1.5molC(s)、1.2molH2O(g)、0.5molCO2(g)、1.4molH2(g),此时v正___v逆(填“>、<或=”)。
(2)煤液化时发生反应:CO(g)+2H2(g)![]() CH3OH(g)ΔH2,在10L恒容密闭容器中按物质的量之比1:2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示,200℃时,n(H2)随时间的变化如下表所示:
CH3OH(g)ΔH2,在10L恒容密闭容器中按物质的量之比1:2充入CO和H2,测得CO的平衡转化率与温度和压强的关系如图所示,200℃时,n(H2)随时间的变化如下表所示:

t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8.0 | 5.4 | 4.0 | 4.0 |
①ΔH2___0(填“>、<或=”)。
②下列说法正确的是___(填标号)。
a.温度越高,该反应的平衡常数越大
b.达平衡后再充入稀有气体,CO的转化率提高
c.容器内气体压强不再变化时,反应达到最大限度
d.图中压强P1<P2
③0-3min内用CH3OH表示的反应速率v(CH3OH)=___mol/(L·min)(结果保留两位有效数值)。
④200℃时,该反应的平衡常数K=___。向上述200℃达到平衡的恒容密闭容器中再加入2molCO、2molH2、2molCH3OH,保持温度不变,则化学平衡___(填“正向”、“逆向”或“不”)移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列说法中正确的是( )
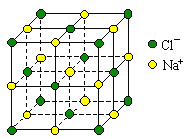
A.1L 1 mol·L-1的醋酸溶液中离子总数为2NA
B.0.05 mol碳酸钠晶体中含离子总数大于0.15NA
C.0.4mol NaCl晶体中含有右图所示的结构单元的数目为0.1NA
D.标准状况下,22.4L CH3Cl和CHCl3的混合物所含有分子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:4NH3(g) + 5O2(g) =4NO(g) + 6H2O(g),△H= —1025kJ/mol,该反应是一个可逆反应,若反应物起始的物质的量相同,下列关于该反应的示意图不正确的是
A. 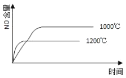
B. 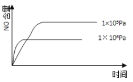
C. 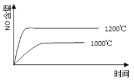
D. 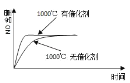
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。

下列说法不正确的是
A. 生成CH3COOH总反应的原子利用率为100%
B. CH4→CH3COOH过程中,有C―H键发生断裂
C. ①→②放出能量并形成了C―C键
D. 该催化剂可有效提高反应物的平衡转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下气体反应达到化学平衡,平衡常数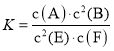 。恒容时,若温度适当降低,F的浓度增加。下列说法正确的是
。恒容时,若温度适当降低,F的浓度增加。下列说法正确的是
A.恒容时,向容器中充入稀有气体,反应速率不变
B.增大c(A)、c(B),K增大
C.该反应的化学方程式为2E(g)+F(s)A(g)+2B(g)
D.正反应为放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。

(1)实验室用装置A制备SO2。某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是: ;
(2)实验室用装置E制备Cl2,其反应的化学化学方程式为:
MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
若有6 mol的HCl参加反应,则转移的电子总数为 ;
(3)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:B: ,D: 。
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B: ,D: 。
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后的漂白性肯定会更强。他们将制得的SO2和Cl2按1∶1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物Y具有保肝、抗炎、增强免疫等功效,可由X制得。下列有关化合物X、Y的说法正确的是

A.一定条件下X可发生氧化、取代、消去反应
B.1 mol Y最多能与4mol NaOH反应
C.X与足量H2反应后,每个产物分子中含有8个手性碳原子
D.等物质的量的X、Y分别与足量Br2反应,最多消耗Br2的物质的量相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com