
【题目】镁与溴化合生成溴化镁,回答下列问题:
(1)镁与溴反应的化学方程式是__。
(2)用电子式表示溴化镁的形成过程__。
(3)用电子式表示离子化合物的形成过程与化学方程式有何不同__。
【答案】Mg+Br2=MgBr2 ![]() ①连接号用“→”,不能用等号,两侧都不能写物质的化学式;②左边写出原子的电子式并用箭头标出电子转移情况;③右边构成离子化合物的每个离子的电子式都要单独写,不能合并,而且要符合相邻关系;④离子的电子式要标离子所带的电荷数,阴离子的电子式要用[ ]表示
①连接号用“→”,不能用等号,两侧都不能写物质的化学式;②左边写出原子的电子式并用箭头标出电子转移情况;③右边构成离子化合物的每个离子的电子式都要单独写,不能合并,而且要符合相邻关系;④离子的电子式要标离子所带的电荷数,阴离子的电子式要用[ ]表示
【解析】
(1)镁与溴反应生成MgBr2;
(2)溴化镁是离子化合物,书写电子式形成过程时需要标明电子转移的方向;
(3)化学方程式是用反应物与生成物的化学式表示反应过程。
(1)镁与溴反应的化学方程式是Mg+Br2=MgBr2;
(2)溴化镁的电子式形成过程为![]() ;
;
(3)用电子式表示离子化合物的形成过程与化学方程式的不同点:①连接号用“→”,不能用等号,两侧都不能写物质的化学式;②左边写出原子的电子式并用箭头标出电子转移情况;③右边构成离子化合物的每个离子的电子式都要单独写,不能合并,而且要符合相邻关系;④离子的电子式要标离子所带的电荷数,阴离子的电子式要用[ ]表示。


科目:高中化学 来源: 题型:
【题目】(1)比较元素非金属性的相对强弱:![]() ________
________![]() (填“>”、“<”或“=”);用一个化学方程式说明
(填“>”、“<”或“=”);用一个化学方程式说明![]() 与
与![]() 氧化性的相对强弱________。
氧化性的相对强弱________。
(2)离子化合物![]() 可被用于治疗消化道疾病,各原子均满足8电子稳定结构。写出
可被用于治疗消化道疾病,各原子均满足8电子稳定结构。写出![]() 的电子式________。
的电子式________。
(3)半导体材料单晶硅的熔点高、硬度大,主要原因是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了清理路面积雪,人们常使用一种融雪剂,其主要成分的化学式为XY2,X、Y均为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 mol XY2含有54 mol 电子。
(1)该融雪剂的化学式是________,该物质中化学键类型是________,电子式是________________。
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是____________;D与E能形成一种结构类似于CO2的三原子分子,且每个原子都达到了8e-稳定结构,该分子的电子式为____________,化学键类型为________________(填“离子键”、“非极性共价键”或“极性共价键”)。
(3)W是与D同主族的短周期元素,Z是第三周期金属性最强的元素,Z的单质在W的常见单质中反应时有两种产物:不加热时生成________,其化学键类型为________;加热时生成________,其化学键类型为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律。
甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素非金属性强弱比较的实验研究;
乙同学设计了如图2装置来验证卤族元素性质的递变规律,A、B、C三处分别是蘸有溴化钠溶液的棉花、湿润的淀粉碘化钾试纸、湿润的红色纸条。
已知常温下浓盐酸与高锰酸钾能反应生成氯气;
可选择的试剂有:大理石、碳酸钠粉末、浓盐酸、稀硝酸、硅酸钠溶液。
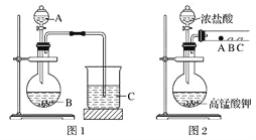
(1)甲同学实验中(图1):
①从给出试剂中选出最佳物质(填化学式):A________,B________。
②烧杯C中发生反应的离子方程式为__________________________。
(2)乙同学实验中(图2):
①写出A处反应的离子方程式________________________。
②B处实验现象是________________________。
③若高锰酸钾的还原产物为Mn2+,当有0.04 mol高锰酸钾参加反应时,则可生成标准状况下的氯气的体积为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示两套实验装置,分别回答下列问题。
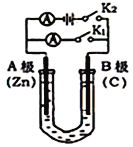
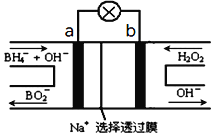
图1 图2
(1)如图1所示,U形管内盛有100mL的溶液,
①打开K2,闭合K1,若所盛溶液为CuSO4溶液:则B极的电极反应式为_______________________。
②打开K1,闭合K2,若所盛溶液为MgCl2溶液,则可观察到的现象是_________________________,总反应化学方程式是_________________________________。
③如要用电解方法精炼粗镍(元素符号Ni),打开K1,闭合K2,电解液选用NiSO4溶液,则A电极的材料应换成是______,反应一段时间后电解质溶液中Ni2+浓度_____(填“增大”、“减小”、“不变”)。
(2)图2装置为硼氢化物NaBH4(B元素的化合价为+3价)燃料电池(DBFC), 由于具有效率高、产物清洁无污染和燃料易于储存和运输等优点,被认为是一种很有发展潜力的燃料电池。
①电池的负极反应式为__________________________
②放电时,每转移2mol电子,理论上需要消耗_________g NaBH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】该装置为锂钒氧化物二次电池,其成本较低,对环境无污染:![]() 在下图中用该电池电解含镍酸性废水可得到单质镍(已知:
在下图中用该电池电解含镍酸性废水可得到单质镍(已知:![]() )。下列说法不正确的是( )
)。下列说法不正确的是( )
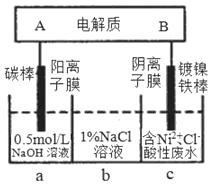
A.该电池充电时,A电极的电极反应式为![]()
B.电解过程中,b中NaCl溶液的物质的浓度会增大
C.当锂钒氧化物二次电池中有7gLi参与放电时,一定能得到29.35g镍
D.锂钒氧化物二次电池一般用非水溶液作为电解液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验研究发现,金属与硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量的铝粉和铁粉的混合物与足量很稀的硝酸充分反应,反应过程中无气体放出,在反应结束后的溶液中逐滴加入5mol/LNaOH溶液,所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示,下列说法不正确的是( )
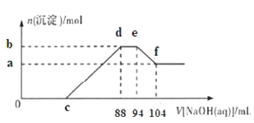
A.硝酸的还原产物全部是![]() B.b点与a点的差值为0.05mol
B.b点与a点的差值为0.05mol
C.原硝酸溶液中硝酸的物质的量为0.47molD.样品中铝粉和铁粉的物质的之比为5:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过量排放含氮物质会污染大气或水体,研究氮及其化合物的性质及转化,对降低含氮物质的污染有着重大的意义。
(1)合成氨反应。
已知,氨的分解反应:2NH3(g) N2(g)+3H2 (g),活化能Ea=600kJmol-1,合成氨有关化学键的键能如下表:
化学键 | H—H | N≡N | N—H |
E/kJmol-1 | 436 | 946 | 391 |
则合成氨反应:![]() N2(g)+
N2(g)+![]() H2(g)NH3(g)的活化能Ea=________。
H2(g)NH3(g)的活化能Ea=________。
(2)已知2NO+O2=2NO2反应历程分两步
方程式 | 活化能 | 焓变 | |
总反应 | 2NO(g)+O2(g)=2NO2(g) |
| △H<0 |
第一步(快速平衡) | 2NO(g)N2O2(g) | Ea1 | △H1 |
第二步(慢反应) | N2O2(g) +O2(g)=2NO2(g) | Ea2 | △H2 |
①平衡常数K可用气体分压来表示,即K的表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数(例如:![]() ),某一时刻第一步达到平衡,写出第一步反应的平衡常数
),某一时刻第一步达到平衡,写出第一步反应的平衡常数![]() ________(用
________(用![]() 和各气体的物质的分数来表示)。
和各气体的物质的分数来表示)。
②用NO表示总反应的速率方程为![]() ;NO2表示的总反应速率方程为
;NO2表示的总反应速率方程为![]() ,
,![]() 与
与![]() 是速率常数,则
是速率常数,则![]() ________。
________。
③下列关于反应2NO(g)+O2(g)=2NO2(g)的说法正确的是________。
A.![]() B.增大压强,反应速率常数增大 C.温度升高,正逆反应速率都增大 D.总反应快慢由第二步决定
B.增大压强,反应速率常数增大 C.温度升高,正逆反应速率都增大 D.总反应快慢由第二步决定
(3)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。
①用活化后的V2O5作催化剂,氨气将NO还原成N2的一种反应历程如图1所示,请写出图1中所示的总反应方程式_______,该反应的含氮气体组分随温度变化如图2所示,当温度大于600K时,可能发生副反应的化学方程式_________。
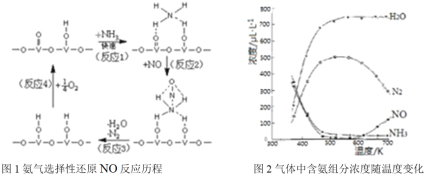
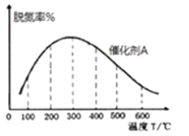
②在有催化剂的作用下,经过相同时间,测得脱氮率随反应温度的变化情况如下图所示,其他条件相同时,请在图中补充在无催化剂作用下脱氮率随温度变化的曲线______________。
(4)电解法处理氮氧化合物是目前大气污染治理的一个新思路,原理是将NOx在电解池中分解成无污染的N2和O2除去,如下图示,两电极间是新型固体氧化物陶瓷,在一定条件下可自由传导O2-,电解池阴极反应为_________。
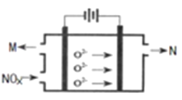
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,容积均恒为2L的甲、乙、丙3个密闭容器中发生反应:
2SO2(g)+O2(g)![]() 2SO3(g) △H=-197kJ·mol-l。实验测得起始、平衡时的有关数据如下表:
2SO3(g) △H=-197kJ·mol-l。实验测得起始、平衡时的有关数据如下表:
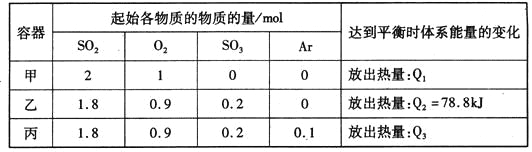
下列叙述正确的是
A. Q1>Q3>Q2=78.8kJ
B. 三个容器中反应的平衡常数均为K=2
C. 甲中反应达到平衡时,若升高温度,则SO2的转化率将大于50%
D. 若乙容器中的反应经tmin达到平衡,则0~tmin内,v(O2)=![]() mol/(L·min)
mol/(L·min)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com