
【题目】过量排放含氮物质会污染大气或水体,研究氮及其化合物的性质及转化,对降低含氮物质的污染有着重大的意义。
(1)合成氨反应。
已知,氨的分解反应:2NH3(g) N2(g)+3H2 (g),活化能Ea=600kJmol-1,合成氨有关化学键的键能如下表:
化学键 | H—H | N≡N | N—H |
E/kJmol-1 | 436 | 946 | 391 |
则合成氨反应:![]() N2(g)+
N2(g)+![]() H2(g)NH3(g)的活化能Ea=________。
H2(g)NH3(g)的活化能Ea=________。
(2)已知2NO+O2=2NO2反应历程分两步
方程式 | 活化能 | 焓变 | |
总反应 | 2NO(g)+O2(g)=2NO2(g) |
| △H<0 |
第一步(快速平衡) | 2NO(g)N2O2(g) | Ea1 | △H1 |
第二步(慢反应) | N2O2(g) +O2(g)=2NO2(g) | Ea2 | △H2 |
①平衡常数K可用气体分压来表示,即K的表达式中用平衡分压代替平衡浓度,分压=总压×物质的量分数(例如:![]() ),某一时刻第一步达到平衡,写出第一步反应的平衡常数
),某一时刻第一步达到平衡,写出第一步反应的平衡常数![]() ________(用
________(用![]() 和各气体的物质的分数来表示)。
和各气体的物质的分数来表示)。
②用NO表示总反应的速率方程为![]() ;NO2表示的总反应速率方程为
;NO2表示的总反应速率方程为![]() ,
,![]() 与
与![]() 是速率常数,则
是速率常数,则![]() ________。
________。
③下列关于反应2NO(g)+O2(g)=2NO2(g)的说法正确的是________。
A.![]() B.增大压强,反应速率常数增大 C.温度升高,正逆反应速率都增大 D.总反应快慢由第二步决定
B.增大压强,反应速率常数增大 C.温度升高,正逆反应速率都增大 D.总反应快慢由第二步决定
(3)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。
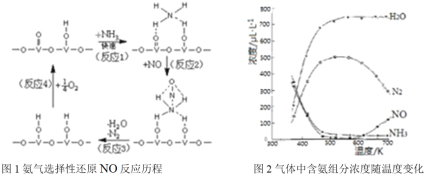
①用活化后的V2O5作催化剂,氨气将NO还原成N2的一种反应历程如图1所示,请写出图1中所示的总反应方程式_______,该反应的含氮气体组分随温度变化如图2所示,当温度大于600K时,可能发生副反应的化学方程式_________。
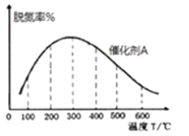
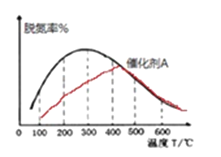
②在有催化剂的作用下,经过相同时间,测得脱氮率随反应温度的变化情况如下图所示,其他条件相同时,请在图中补充在无催化剂作用下脱氮率随温度变化的曲线______________。
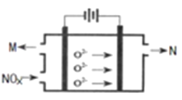
(4)电解法处理氮氧化合物是目前大气污染治理的一个新思路,原理是将NOx在电解池中分解成无污染的N2和O2除去,如下图示,两电极间是新型固体氧化物陶瓷,在一定条件下可自由传导O2-,电解池阴极反应为_________。
【答案】254kJmol-1  1 CD
1 CD ![]()
![]() 或
或![]()
![]()
【解析】
(1)△H=反应物总键能生成物总键能,可以算出反应热,焓变等于正逆反应的活化能之差,且物质的量与能量成正比;
(2)①K=![]() ;
;
②平衡时,根据反应速率与计量系数成正比,v(NO)=v(NO2),代入计算即可;
③A、总反应的活化能由决速步骤决定,即由慢反应决定;
B、平衡常数只与温度有关;
C、结合温度对已发生了的影响判断;
D、总反应快慢由活化能大的决定,活化能越大,反应速率越慢。
(3)①根据图示1可知NH3、NO、O2反应生成N2和H2O,据此书写方程式;根据图2,发生副反应产生NO,据此书写方程式;
②催化剂可加快反应速率,缩短反应时间,平衡不移动,相同时间内,没有催化剂时单位时间内脱氮率将下降,反应后半段与原图象重合;
(4)由题意可知NOx经电解形成N2,电极反应式需要结合电子转移、电荷守恒。
(1)△H=反应物总键能生成物总键能,△H=![]() ×(N≡N)+
×(N≡N)+![]() ×(HH)3×(NH)=
×(HH)3×(NH)=![]() ×946kJ/mol+
×946kJ/mol+![]() ×436kJ/mol3×391kJ/mol=46kJ/mol,△H=正反应活化能逆反应活化能,则46=Ea
×436kJ/mol3×391kJ/mol=46kJ/mol,△H=正反应活化能逆反应活化能,则46=Ea![]() ×600,Ea=254kJ/mol,故答案为:254kJ/mol;
×600,Ea=254kJ/mol,故答案为:254kJ/mol;
(2)①根据平衡常数KP=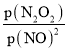 =
= ,故答案为:
,故答案为: ;
;
②平衡时,根据反应速率与计量系数成正比,v(NO)=v(NO2),即k1c(NO)c(O2)=k2c(NO)c(O2),则k1=k2,![]() =1,故答案为:1;
=1,故答案为:1;
③A、总反应的活化能由决速步骤决定,即由慢反应决定,故A错误;
B、平衡常数只与温度有关,故B错误;
C、温度升高,正逆反应速率都增大,故C正确;
D、总反应快慢由慢反应决定,故D正确;
故答案为:CD;
(3)①根据图示1可知NH3、NO、O2反应生成N2和H2O,方程式为:4NH3+4NO+O2=4N2
②催化剂可加快反应速率,缩短反应时间,平衡不移动。相同时间内,没有催化剂时单位时间内脱氮率将下降,由此作图: ,故答案为:
,故答案为: ;
;
(4)由题意可知NOx经电解形成N2,结合电子转移、电荷守恒,阴极反应为:![]() ,故答案为:
,故答案为:![]() 。
。


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】铝热反应不仅用于焊接钢轨,而且还常用于冶炼熔点较高的金属如钒、铬、锰等。
请配平下列用铝热反应冶炼金属钒和钴的化学方程式,指出哪些物质是还原剂、哪些物质是氧化剂,并计算生成1 mol各种金属分别需要纯铝的质量。
V2O5+Al——Al2O3+V Co3O4+Al——Al2O3+Co
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁与溴化合生成溴化镁,回答下列问题:
(1)镁与溴反应的化学方程式是__。
(2)用电子式表示溴化镁的形成过程__。
(3)用电子式表示离子化合物的形成过程与化学方程式有何不同__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应①2BrO3-+Cl2=Br2+2ClO3-;②5Cl2+I2+6H2O=2HIO3+10HCl;③ClO3-+5Cl-+6H+=3Cl2+3H2O。下列物质氧化能力强弱顺序正确的是
A.![]() B.
B.![]()
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列判断中一定正确的是( )
A. NaCl及Na2O2固体中阴、阳离子数之比均为1:1
B. 等质量的O2与O3中,氧原子的个数比为3:2
C. 分别用H2O2、KMnO4分解制O2,当制得等质量O2时,转移电子数之比为1:2
D. 10 mL 0.3 mol·L-1 NaCl溶液与30 mL 0.1 mol·L-1 AlCl3溶液中Cl -物质的量浓度比为1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为V L的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应H2(g)+Br2(g)![]() 2HBr(g);ΔH<0。当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示。下列说法正确的是
2HBr(g);ΔH<0。当温度分别为T1、T2,平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示。下列说法正确的是
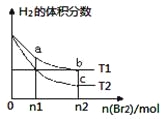
A. 若b、c点的平衡常数分别为K1、K2,则K1>K2
B. a、b两点的反应速率:b>a
C. 为了提高Br2(g)的转化率,可采取增加Br2(g)通入量的方法
D. 若平衡后保持温度不变,压缩容器体积平衡一定不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,反应H2(g)+CO2(g)![]() H2O(g)+CO(g)的平衡常数K=
H2O(g)+CO(g)的平衡常数K=![]() 。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
。该温度下,在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示:
甲 | 乙 | 丙 | |
c(H2)/(mol·L-1) | 0.010 | 0.020 | 0.020 |
c(CO2)/(mol·L-1) | 0.010 | 0.010 | 0.020 |
下列判断不正确的是( )
A. 反应开始时,丙容器中化学反应速率最大,甲容器中化学反应速率最小
B. 平衡时,乙容器中CO2的转化率大于60%
C. 平衡时,甲容器中和丙容器中H2的转化率均是60%
D. 平衡时,丙容器中c(CO2)是甲容器中的2倍,是 0.012 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米氧化锌是一种多功能性的新型无机材料,在橡胶、玻璃、涂料等各个领域广泛的应用。工业由粗氧化锌(含少量FeO、CuO 等杂质) 制备活性氧化锌的工业流程如下:

已知:Fe3+、Fe2+、Cu2+完全沉淀的pH分别是:3.2,8.1,6.7
(1)“酸浸”时用的硫酸溶液的密度为1.4g/mL,质量分数为70%,则该硫酸的物质的量浓度为____。
(2)焙烧前粉碎的目的是____________________________________________。
(3)滤液中加锌粉的目的是_____________________________________。
(4)物质A的主要成分_______________(填化学式),检验A中阳离子的方法是_______________。
(5)滤液中加H2O2发生反应的离子方程式__________________________。
(6)6.82g碱式碳酸锌[aZn(OH)2·bZnCO3·cH2O]恰好溶解在40mL3mol/LHCl中,同时产生448mLCO2(标准状况下),试推算碱式碳酸锌的化学式为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知K2Cr2O7溶液中存在平衡: Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+2H+。保持温度不变,用K2Cr2O7溶液进行下列实验:
2CrO42-(黄色)+2H+。保持温度不变,用K2Cr2O7溶液进行下列实验:
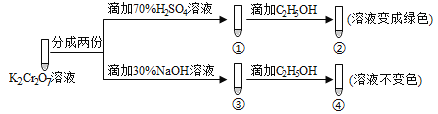
结合实验,下列说法正确的是
A. ①中溶液变黄,③中溶液橙色加深
B. 上述可逆反应的平衡常数:①<③
C. K2Cr2O7溶液的氧化性在酸性条件下更强
D. 若向④中加入70%H2S04溶液至过量,溶液变为橙色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com