
【题目】对于放热反应Zn+H2SO4=ZnSO4+H2↑,下列叙述正确的是
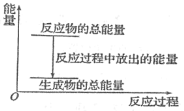
A.反应过程中的能量关系可用上图表示
B.1 mol Zn的能量大于1 mol H2的能量
C.若将其设计为原电池,则其能量转化形式为电能转化为化学能
D.若将其设计为原电池,当有32.5 g Zn溶解时,正极放出的气体一定为11.2 L
【答案】A
【解析】
A. 该反应为放热反应,反应物的总能量高于生成物的总能量 ,所以其反应过程中的能量关系可用上图表示,A叙述正确;
B. 放热反应中,反应物的总能量高于生成物的总能量,但不能确定1 mol Zn的能量是否大于1 mol H2的能量,B叙述不正确;
C. 若将其设计为原电池,则其能量转化形式为化学能转化为电能,C叙述不正确;
D. 若将其设计为原电池,当有32.5 g Zn(物质的量为0.5mol)溶解时,Zn失去1mol电子,若化学能完全转化为电能,则正极放出的氢气在标准状况下为11.2 L,但是未指明温度和压强,不能确定一定是11.2 L,D说法不正确。
本题选A。


科目:高中化学 来源: 题型:
【题目】(1)在AlCl3溶液中滴加过量的氨水,反应的化学方程式为__________________。
(2)碳酸氢钠与稀硫酸反应的离子方程式__________________;铜与浓硫酸共热反应的化学方程式__________________。
(3)现有0.284kg质量分数为10%的Na2SO4溶液,则溶液中Na2SO4的物质的量为______;配制250mL2.0mol/LH2SO4溶液,需要18mol/LH2SO4溶液的体积_________mL。
(4)同一主族元素性质具有一定的相似性和递变性;同一主族,从上到下:原子的电子层数逐渐____________,原子半径逐渐____________;失电子能力逐渐____________,金属性逐渐____________ ;得电子能力逐渐 ___________,非金属性逐渐____________ 。
(5)A、B、C、D、E五种元素,它们的核电荷数依次增大,且都小于20。其中A为非金属元素,C是金属元素;A、C元素原子的最外层都只有一个电子;B和D元素原子的最外层电子数相同,且B元素原子L层电子数是K层电子数的3倍;E元素原子最外层电子数比次外层电子数少1。回答下列问题:
写出E元素的元素符号:________画出B、C的原子结构示意图:B.________C________画出D的离子结构示意图:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.1996年人工合成了第112 号元素鎶(Cn),盛放鎶的容器上应该贴的标签是![]()
B.Na、Al、Cu可以分别用热还原法、热分解法和电解法冶炼得到
C.铜、冰醋酸、酒精分别属于强电解质、弱电解质、非电解质
D.煤的气化与液化均属于化学变化,煤的干馏属于物理变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M 的结构简式如下:下列有关M 叙述不正确的是( )
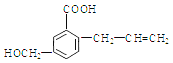
A. M的分子式为C11H12O3
B. 能使溴的四氯化碳溶液褪色
C. 一定条件下,M能生成高分子化合物
D. 能发生加成反应不能发生取代反应
【答案】D
【解析】
试题A.根据物质的结构简式可知M的分子式是C11H12O3,正确; B.该物质的分子中含有碳碳双键,因此能使溴的四氯化碳溶液褪色,正确;C. 该物质的分子中含有碳碳双键,在一定条件下发生加聚反应形成高聚物,正确;D. 化合物M含有碳碳双键,因此能发生加成反应,含有醇羟基、羧基,因此可以发生取代反应,错误。
考点:考查有机物的结构与性质的关系的知识。
【题型】单选题
【结束】
22
【题目】下列有关金属腐蚀与防护的说法不正确的是( )
A. 钢铁发生电化学腐蚀时,若表面水膜呈中性,则正极发生的反应为:2H2O+O2+4e一= 4OH一
B. 在潮湿的空气中,黄铜(铜锌合金)制品比纯铜制品更易产生铜绿
C. 金属制品在海水中比淡水中更容易发生腐蚀
D. 从本质上看,金属腐蚀是金属原子失去电子变成阳离子被氧化的过程
【答案】B
【解析】A、钢铁发生电化学腐蚀时,若表面水膜呈中性发生吸氧腐蚀,则正极发生的反应为:2H2O+O2+4e一=4OH一,A正确;B、在潮湿的空气中易发生电化学腐蚀,锌的金属性强于铜,因此黄铜(铜锌合金)制品比纯铜制品更不易产生铜绿,B错误;C、海水中含电解质浓度大,淡水中含电解质浓度小,故金属制品在海水中比淡水中更容易发生腐蚀,C正确;D、从本质上看,金属腐蚀是金属原子失去电子变成阳离子被氧化的过程,D正确;答案选B。
【题型】单选题
【结束】
23
【题目】下列说法不正确的是
A. 麦芽糖及其水解产物均能发生银镜反应
B. 用溴水即可鉴别苯酚溶液,2,4-已二烯和甲苯
C. 在酸性条件下,![]() 的水解产物是
的水解产物是![]() 和
和![]()
D. 用甘氨酸![]() 和丙氨酸
和丙氨酸![]() 缩合最多可形成4种二肽
缩合最多可形成4种二肽
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家发现铂的两种化合物a和b(见图),实验测得a和b具有不同的性质,且a具有抗癌作用,而b没有。下列关于a、b的叙述错误的是 ( )

A.a和b互为同分异构体B.a和b的空间构型是平面四边形
C.a和b互为镜像的关系D.a和b分别是非极性分子和极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列有关电解质溶液的说法正确的是( )
A. 将Na2CO3溶液用水稀释后,pH变大,Kw不变
B. 向有AgCl固体的饱和溶液中加少许水,c(Ag+)和Ksp(AgCl)都不变
C. pH=4.75浓度均为0.1mol/L的CH3COOH、CH3COONa的混合溶液中:c(CH3COO-)+c(OH-)<c(H+)+c(CH3COOH)
D. 分别用pH=2和pH=3 的 CH3COOH溶液中和等物质的量的NaOH,消耗CH3COOH溶液的体积分别为Va和Vb,则10Va=Vb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计了如图所示装置。
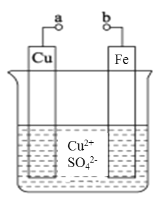
下列叙述不正确的是
A.a和b不连接时,Fe片上会有金属 Cu析出
B.a和b用导线连接时,Cu 片上发生的反应为Cu2++2e- =Cu
C.a和b导线连接时,电子从Fe 电极经溶液流向Cu电极
D.a和b用导线连接后.电流由Fe电极经导线流向Cu 电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中正确的是
A.用铁电极电解饱和食盐水:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑
B.Fe(NO3)3溶液中加入过量的HI溶液2Fe3++2I-=2Fe2++I2
C.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
D.向Mg(HCO3)2溶液中加入过量的NaOH溶液:Mg2++2HCO3-+4OH-=Mg(OH)2↓+2CO32-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮氧化物的反应机理,对于消除环境污染有重要意义。
(1)升高温度绝大多数的化学反应速率增大,但是2NO(g)+O2(g)![]() 2NO2(g)的速率却随温度的升高而减小,某化学小组为研究特殊现象的实质原因,查阅资料知:2NO(g)+O2(g)
2NO2(g)的速率却随温度的升高而减小,某化学小组为研究特殊现象的实质原因,查阅资料知:2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
i:2NO(g)![]() N2O2(g)(快),v1正=k1正c2(NO) v1逆=k1逆c(N2O2) ΔH1<0
N2O2(g)(快),v1正=k1正c2(NO) v1逆=k1逆c(N2O2) ΔH1<0
ii:N2O2(g)+O2(g)![]() 2NO2(g)(慢),v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2) ΔH2<0
2NO2(g)(慢),v2正=k2正c(N2O2)c(O2) v2逆=k2逆c2(NO2) ΔH2<0
请回答下列问题:
①一定温度下,反应2NO(g)+O2(g)![]() 2NO2(g)达到衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=________
2NO2(g)达到衡状态,请写出用k1正、k1逆、k2正、k2逆表示的平衡常数表达式K=________
②由实验数据得到v2正~c(O2)的关系可用如图表示。当x点升高到某一温度时,反应重新达到平衡,则变为相应的点为___________(填字母)。
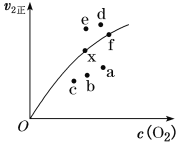
(2)100℃时,若将0.100 mol N2O4气体放入1 L密闭容器中,发生反应N2O4(g)![]() 2NO2(g) ΔH=+24.4 kJ·mol-1。c(N2O4)随时间的变化如表所示。回答下列问题:
2NO2(g) ΔH=+24.4 kJ·mol-1。c(N2O4)随时间的变化如表所示。回答下列问题:

①在0~40 s时段,化学反应速率v(NO2)为______ mol·L-1·s-1
②下列能说明该反应达到平衡状态的是________(填选项字母)。
A.2v(N2O4)=v(NO2) B.体系的颜色不再改变
C.混合气体的密度不再改变 D.混合气体的压强不再改变
③该反应达到平衡后,若只改变一个条件,达到新平衡时,下列能使NO2的体积分数增大的是_________(填选项字母)。
A.充入一定量的NO2 B.增大容器的容积
C.分离出一定量的NO2 D.充入一定量的N2
④100℃时,若将9.2 g NO2和N2O4气体放入1 L密闭容器中,发生反应N2O4(g)![]() 2NO2(g)。某时刻测得容器内气体的平均相对分子质量为50,则此时v正(N2O4)_______v逆(N2O4)(填“>”“=”或“<”)。
2NO2(g)。某时刻测得容器内气体的平均相对分子质量为50,则此时v正(N2O4)_______v逆(N2O4)(填“>”“=”或“<”)。
⑤上述反应中,正反应速率v正=k正·p(N2O4),逆反应速率v逆=k逆·p2(NO2),其中k正、k逆为速率常数,若将一定量N2O4投入真空容器中恒温恒压分解(温度298 K、压强100 kPa),已知该条件下k正=4.8×104 s-1,当
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com