
| 选项 | 离子方程式 | 所对应的化学反应 |
| A | HCO3-+OH-+Ca2+═CaCO3↓+H2O | 既可以表示少量NaHCO3与过量石灰水反应,也可以表示少量NaOH与过量Ca(HCO3)2反应 |
| B | H++OH-═H2O | 代表任何强酸与强碱反应 |
| C | Fe+2H+═Fe2++H2↑ | 代表铁与所有强酸反应 |
| D | Al3++4NH3•H2O═4NH4++AlO2-+2H2O | 代表可溶性铝盐与过量氨水反应 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.少量NaHCO3与过量石灰水反应,生成碳酸钙、NaOH和水;少量NaOH与过量Ca(HCO3)2反应,生成碳酸氢钠、碳酸钙、水;
B.硫酸与氢氧化钡的离子反应不能用H++OH-═H2O表示;
C.硝酸、浓硫酸等具有强氧化性;
D.氢氧化铝不溶于氨水.
解答 解:A.少量NaHCO3与过量石灰水反应,生成碳酸钙、NaOH和水;少量NaOH与过量Ca(HCO3)2反应,生成碳酸氢钠、碳酸钙、水,离子反应均为HCO3-+OH-+Ca2+═CaCO3↓+H2O,故A正确;
B.硫酸与氢氧化钡的离子反应不能用H++OH-═H2O表示,漏写生成硫酸钡沉淀的离子反应,故B错误;
C.硝酸、浓硫酸等具有强氧化性,与Fe反应不生成氢气,则Fe+2H+═Fe2++H2↑可表示Fe与盐酸、稀硫酸的离子反应,故C错误;
D.氢氧化铝不溶于氨水,则可溶性铝盐与过量氨水反应的离子反应为Al3++3NH3•H2O═3NH4++Al(OH)3↓,故D错误;
故选A.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 Ⅰ.甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究.向A中通入氯气至过量,观察A中,发现溶液先呈红色,然后变为黄色.
Ⅰ.甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究.向A中通入氯气至过量,观察A中,发现溶液先呈红色,然后变为黄色. .甲同学猜想SCN-可能被Cl2氧化了,他进行了如下研究;
.甲同学猜想SCN-可能被Cl2氧化了,他进行了如下研究; ,偏碱性条件下,氰化钠溶液的CN-被双氧水氧化为HCO3-,同时放出NH3,该反应的离子方程式:CN-+H2O2+H2O═NH3↑+HCO3-;
,偏碱性条件下,氰化钠溶液的CN-被双氧水氧化为HCO3-,同时放出NH3,该反应的离子方程式:CN-+H2O2+H2O═NH3↑+HCO3-;| 步骤:分别取等体积、等浓度的含氰废水于甲、乙两支试管中,再分别加入等体积、等浓度的双氧水溶液,只向甲试管中加入少量的无水硫酸铜粉末,用离子色谱仪测定相同反应时间内两支试管中的CN-浓度 | 现象与结论: 若甲试管中的CN-浓度小于乙试管中的CN-浓度,则Cu2+对双氧水破氰反应起催化作用 若两试管中的CN-浓度相同,则Cu2+对双氧水破氰反应不起催化作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式为:CH2=CH2 | |
| B. | 乙醇的结构式为: | |
| C. | 用电子式表示Na2S的形成过程可表示为: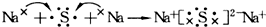 | |
| D. | 丙烷的比例模型为: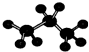 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
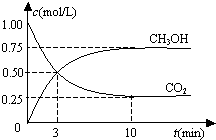 恒温恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:
恒温恒容密闭容器中充入1mol CO2和3mol H2,一定条件下发生反应:| A. | 该密闭容器的体积为1 L | |
| B. | 反应达平衡,氢气的转化率为0.75 | |
| C. | 反应达平衡,氢气平均反应速率0.075 mol/(L•min) | |
| D. | CO2或H2O物质的量不再改变时反应达平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | AgCl | AgI | Ag2S |
| 颜色 | 白 | 黄 | 黑 |
| Ksp(25℃) | 1.8×10-10 | 1.5×10-16 | 1.8×10-50 |
| A. | 溶度积小的沉淀可以转化为溶度积更小的沉淀 | |
| B. | 若先加入Na2S溶液,再加入KI溶液,则无黄色沉淀产生 | |
| C. | 25℃时,饱和AgCl、AgI、Ag2S溶液中所含Ag+的浓度相同 | |
| D. | 25℃时,AgCl固体在等质的量浓度的NaCl、CaCl2溶液中的溶度积相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 探究SO2的性质.甲组同学将SO2分别通入下列3种溶液中.
探究SO2的性质.甲组同学将SO2分别通入下列3种溶液中.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | N≡N | N-H |
| 键能(kJ/mol) | 436 | 946 | 391 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 反应①、③均属于取代反应 | B. | 反应②、④均属于氧化反应 | ||
| C. | 加入酸性K2Cr2O7溶液可实现反应⑤ | D. | 加入NaOH溶液可实现反应⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com