
【题目】下列有关纯碱和小苏打的叙述中正确的是( )
A.Na2CO3和NaHCO3都既能与酸反应,又能与氢氧化钠溶液反应
B.等质量的Na2CO3、NaHCO3分别与足量的同浓度的盐酸反应,NaHCO3消耗的盐酸比Na2CO3多
C.向NaHCO3溶液中滴入Ba(OH)2溶液无沉淀,而Na2CO3溶液中加入Ba(OH)2溶液出现白色沉淀
D.等质量的Na2CO3、NaHCO3分别与足量的稀H2SO4反应,NaHCO3产生CO2比Na2CO3多
【答案】D
【解析】
A.Na2CO3和NaHCO3都能与酸反应,但是,NaHCO3能与氢氧化钠溶液反应,而Na2CO3不能与氢氧化钠溶液反应,故A错误;
B.Na2CO3和NaHCO3都能与酸反应,离子反应方程式为:CO32-+2H+=H2O+CO2↑,HCO3-+H+=H2O+CO2↑,设NaHCO3和Na2CO3的质量为m g,Na2CO3消耗HCl ![]() ×2mol,NaHCO3消耗盐酸
×2mol,NaHCO3消耗盐酸 ![]() mol,
mol,![]() ×2mol>
×2mol>![]() mol,即Na2CO3消耗的盐酸比等质量的NaHCO3多,故B错误;
mol,即Na2CO3消耗的盐酸比等质量的NaHCO3多,故B错误;
C.向NaHCO3溶液和Na2CO3溶液中分别滴入Ba(OH)2溶液都出现白色沉淀,故C错误;
D.等质量的Na2CO3、NaHCO3分别与足量的稀H2SO4反应,离子反应方程式为:CO32-+2H+=H2O+CO2↑,HCO3-+H+=H2O+CO2↑,硫酸足量,NaHCO3和Na2CO3全部转化为CO2,根据碳原子守恒,碳原子的物质的量越大,生成二氧化碳越多,设NaHCO3和Na2CO3的质量均为m g,Na2CO3的物质的量为![]() mol,NaHCO3的物质的量为
mol,NaHCO3的物质的量为 ![]() mol,
mol,![]() mol<
mol<![]() mol,则NaHCO3产生CO2比Na2CO3多,故D正确;
mol,则NaHCO3产生CO2比Na2CO3多,故D正确;
答案选D。


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:
【题目】对于可逆反应:2SO2(g)+O2(g) ![]() 2SO3(g) ΔH=-a kJ·mol-1。下列说法正确的是( )
2SO3(g) ΔH=-a kJ·mol-1。下列说法正确的是( )
A.在接触法制取硫酸工艺中,该反应在沸腾炉内发生
B.如果用 18O2代替O2发生上述反应,则经过一段时间可测得容器中存在S18O2、S18O3
C.2 mol SO2与2 mol O2充分反应后放出a kJ的热量
D.该反应达到平衡后,c(SO2)∶c(O2)∶c(SO3)=2∶1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:①N2(g)+O2(g)=2NO(g) ΔH=180.5 kJ·mol-1
②C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ· mol-1
③2C(s)+O2(g)= 2CO(g) ΔH=-221 kJ· mol-1
若某反应Ⅰ的平衡常数表达式为K=![]() 请写出此反应的热化学方程式:________,该反应自发进行的条件是_________。
请写出此反应的热化学方程式:________,该反应自发进行的条件是_________。
(2)一定温度下,向体积为V L的密闭容器中充入一定量的NO和CO,发生反应Ⅰ。
①下列说法正确的是____。
A 当容器内气体压强不再发生变化时,说明反应已达到平衡状态
B 当v(CO2)=v(CO)时,说明反应已达到平衡状态
C 达到平衡后,若向容器中再充入一定量NO,则NO转化率将减小
D 达到平衡后,若再升高温度,由于逆反应速率增大,正反应速率减小,因此平衡向逆反应方向移动
②若反应在t1时刻达到平衡状态,在其他条件不变的情况下,t2时刻通过缩小容器体积使压强增大到原来的2倍,t3时刻达到新的平衡状态。请在图中补充画出t2~t4时段c(NO)的变化曲线: ____

(3)分离高炉煤气得到的CO与空气可设计成燃料电池而除去(以KOH溶液为电解质溶液)。写出该电池的负极反应式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】选做(1)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的ΔH表示生成1 mol产物的数据)。根据下图回答下列问题:
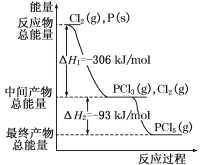
(a)P和Cl2反应生成PCl3的热化学方程式是______________________________ ;
(b)P和Cl2分两步反应生成1 mol PCl5的ΔH3=____________________,P和Cl2一步反应生成1 mol PCl5的ΔH4____________ΔH3(填“大于”.“小于”.或“等于”)。
(2)在微生物作用的条件下,NH经过两步反应被氧化成NO。这两步的能量变化示意图如下:

(a)第二步反应是________反应(选填“放热”或“吸热”),判断依据是__________ 。
(b)1molNH4+(aq)全部氧化成NO2-(aq)的热化学方程式是_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向含Al2(SO4)3和AlCl3的混合溶液中逐滴加人1mol/L Ba(OH)2溶液至过量,加入Ba(OH)2溶液的体积和所得沉淀的物质的量的关系如图,下列说法不正确的是( )

A. 图中C点铝元素存在形式是AlO2—
B. 向D点溶液中通人C02气体,立即产生白色沉淀
C. 原混合液中c[Al2(SO4)3]:c(AlCl3)=1:2
D. OA段反应的离子方程式为:3Ba2++2Al3++8OH-+3SO4=BaSO4↓+2AlO2-+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以证明可逆反应N2+3H2![]() 2NH3已达到平衡状态的是:①一个N≡N键断裂的同时,有3个H—H键断裂;②一个N
2NH3已达到平衡状态的是:①一个N≡N键断裂的同时,有3个H—H键断裂;②一个N![]() N键断裂的同时,有6个N—H键断裂;③其他条件不变时,混合气体平均相对分子质量不再改变;④保持其他条件不变时,体系压强不再改变;⑤NH3%、N2%、H2%都不再改变;⑥恒温恒容时,密度保持不变;⑦正反应速率v(H2)=0.6 mol·(L·min)-1逆反应速率v(NH3)=0.4 mol·(L·min)-1。
N键断裂的同时,有6个N—H键断裂;③其他条件不变时,混合气体平均相对分子质量不再改变;④保持其他条件不变时,体系压强不再改变;⑤NH3%、N2%、H2%都不再改变;⑥恒温恒容时,密度保持不变;⑦正反应速率v(H2)=0.6 mol·(L·min)-1逆反应速率v(NH3)=0.4 mol·(L·min)-1。
A.全部B.①③④⑤C.②③④⑤⑦D.①③⑤⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置图的使用说法正确的是
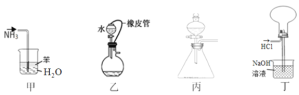
A.甲装置吸收 NH3制氨水
B.乙装置需添加其它仪器才能检验其气密性
C.丙装置中,向酸性高锰酸钾溶液中滴加草酸溶液,溶液的紫红色逐渐褪去
D.丁装置收集并吸收多余的 HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯的结构简式可用![]() 来表示,下列关于苯的叙述中正确的是
来表示,下列关于苯的叙述中正确的是
A. 苯主要是以石油为原料而获得的一种重要化工原料
B. 苯中含有碳碳双键,所以苯属于烯烃
C. 苯分子中6个碳碳化学键完全相同
D. 苯可以与溴水、高锰酸钾溶液反应而使它们褪色
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com