
【题目】使用分液漏斗时,应首先( )
A.洗涤B.检查是否漏水C.打开玻璃塞D.打开活塞
科目:高中化学 来源: 题型:
【题目】铝热反应是铝的一个重要性质,该性质用途十分广泛.“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”“纸漏斗的下部被烧穿,有熔融物落入沙中”.已知:Al、Al2O3、Fe、Fe2O3的熔点、沸点数据如表:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2 054 | 1 535 | 1 462 |
沸点/℃ | 2 467 | 2 980 | 2 750 | - |
I.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金.理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金.你认为他的解释是否合理? ______ (填“合理”或“不合理”).
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝,反应的离子方程式为 ______ .
(3)实验室溶解该熔融物,在下列试剂中最适宜的试剂是 ______ (填序号).
A、浓硫酸B、稀硫酸 C、稀硝酸D、氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入6molL-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:
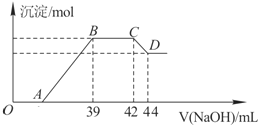
(1)依题意,请写出熔融物中铁与该稀的硝酸反应的离子方程式: ______
(2)在BC段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为 ______ ;
(3)熔融物中铝元素的物质的量为 ______ mol.
(4)B点对应的沉淀的物质的量为 ______ mol,A点对应的氢氧化钠溶液的体积为 ______ mL.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温下,下列关于电解质的说法中正确的是
A. 中和等体积、等浓度的氨水和氢氧化钠溶液至pH=7,前者消耗的盐酸多
B. 向NH4Cl溶液中加入少量等浓度的稀盐酸,则![]() 的值减小
的值减小
C. 向NaHS溶液中加入适量 KOH 后:c(Na+)=c(H2S)+c(HS-)+c(S2-)
D. 将a mol·L-1的醋酸与0.01 mol·L-1的氢氧化钠溶液等体积混合(忽略体积、温度变化),所得溶液中c(Na+)=c(CH3COO-),则醋酸的电离常数Ka=![]() (用含a的代数式表示)
(用含a的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫和钙的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)基态Ca原子中,核外电子占据最高能层的符号是________,该能层为次外层时最多可以容纳的电子数为_________。元素Ca和S相比,第一电离能较大的是______(填元素符号)。
(2)钙元素的焰色反应呈砖红色,其中红色对应的辐射与钾元素的焰色反应对应颜色的辐射波长,较短的是_______(填元素符号)。
(3)H2S和H2O分子构型都为V形,中心原子的杂化形式都是______,但H2O分子键角大于H2S分子,原因是________________。
(4)钙元素和锰元素属于同一周期,且核外最外层电子构型相同,但金属钙的熔点、沸点等都比金属锰低,原因是________________。
(5)Ca、Mn、Mg的氧化物和硫化物都具是NaCl型结构的离子晶体,其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得它们的晶胞参数如下表:
氧化物晶体 | MgO | MnO | CaO |
a/nm | 0.421 | 0.444 | 0.480 |
硫化物晶体 | MgS | MnS | CaS |
a/nm | 0.520 | 0.520 | 0.568 |
由表可知:r(S2-)____r(O2-)(填“>”或“<”),r(Mg2+)、r(Ca2+)、r(Mn2+)由大到小的的顺序是__________,r(S2- )为_____nm,r(Ca2+)为_____nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子.N4分子结构如图所示,已知断裂1molN﹣N吸收167kJ热量,生成1molN≡N放出942kJ.根据以上信息和数据,下列说法正确的是( ) 
A.N4属于一种新型的化合物
B.N4与N2互为同素异形体
C.N4沸点比P4 (白磷)高
D.1mo1N4气体转变为N2将吸收882kJ热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基甲酸铵分解反应为NH2COONH4(s)![]() 2NH3(g)+CO2(g),在一体积恒定的容器里,发生上面的反应,可以判断该反应已经达到平衡的是:
2NH3(g)+CO2(g),在一体积恒定的容器里,发生上面的反应,可以判断该反应已经达到平衡的是:
A. 密闭容器中氨气的体积分数不变
B. 1mol NH2COONH4分解同时有17g NH3消耗
C. 密闭容器中混合气体的密度不变
D. 2v(NH3)=v(CO2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在4 L密闭容器中充入6 mol A气体和5 mol B气体,在一定条件下发生反应:3A(g)+B(g) ![]() 2C(g)+xD(g),5 s达到平衡。达到平衡时,生成了2 mol C,经测定D的浓度为0.5 mol·L-1,下列判断正确的是( )
2C(g)+xD(g),5 s达到平衡。达到平衡时,生成了2 mol C,经测定D的浓度为0.5 mol·L-1,下列判断正确的是( )
A. x=1 B. B的转化率为20%
C. 平衡时A的浓度为1.50 mol·L-1 D. B的平均反应速率为0.2 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为元素周期表截取的短周期的一部分,四种元素均不是稀有气体元素。下列关于这四种元素及其化合物的说法中正确的是 ( )
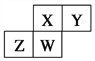
A. 原子半径:W>Z>Y>X
B. 气态氢化物的稳定性:Z>W>X>Y
C. W的最高正化合价与负化合价的绝对值一定不相等
D. Z的最高价氧化物的水化物可能为弱酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com