
����Ŀ�����ȷ�Ӧ������һ����Ҫ���ʣ���������;ʮ�ֹ㷺�������ȷ�Ӧ��������������������������Ӧ�ų��������ȣ�������ҫ�۵Ĺ�â����ֽ©�����²����մ���������������ɳ�С�����֪��Al��Al2O3��Fe��Fe2O3���۵㡢�е����������
���� | Al | Al2O3 | Fe | Fe2O3 |
�۵�/�� | 660 | 2 054 | 1 535 | 1 462 |
�е�/�� | 2 467 | 2 980 | 2 750 | - |
I����1��ijͬѧ�Ʋ⣬���ȷ�Ӧ���õ���������Ӧ�������Ͻ������ǣ��÷�Ӧ�ų�������ʹ���ۻ����������۵�����ͣ���ʱҺ̬���������ۺ��γ������Ͻ�����Ϊ���Ľ����Ƿ������ ______ ���������������������
��2�����һ����ʵ�鷽����֤���������õĿ�״�������к��н���������Ӧ�����ӷ���ʽΪ ______ ��
��3��ʵ�����ܽ��������������Լ��������˵��Լ��� ______ ������ţ���
A��Ũ����B��ϡ���ᡡ������C��ϡ����D������������Һ
��ʵ���о����֣����ᷢ��������ԭ��Ӧʱ�������Ũ��Խϡ����Ӧ��ԭ�����е�Ԫ�صĻ��ϼ�Խ�ͣ�ijͬѧȡһ������������������һ������ϡ�������ַ�Ӧ����Ӧ������������ų����ڷ�Ӧ���������Һ�У���μ���6molL-1������������Һ����������������Һ�������mL��������ij��������ʵ�����mol���Ĺ�ϵ��ͼ��ʾ���Իش��������⣺
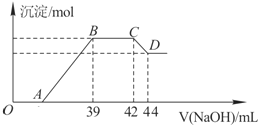
��1�������⣬��д���������������ϡ�����ᷴӦ�����ӷ���ʽ�� ______
��2����BC�Σ����������ʵ���û�б仯����˽η�����Ӧ�����ӷ���ʽΪ ______ ��
��3������������Ԫ�ص����ʵ���Ϊ ______ mol��
��4��B���Ӧ�ij��������ʵ���Ϊ ______ mol��A���Ӧ������������Һ�����Ϊ ______ mL��
���𰸡� ���� 2Al+2OH-+2H2O=2AlO2-+3H2�� B 8Fe+30H++3NO3-=8Fe3++3NH4++9H2O NH4++OH-=NH3H2O 0.012 0.048 15
����������1�������۵�����ͣ���������Һ̬��һ�������ʢ��ɳ�ӵ��������γɺϽ��������ȷ�Ӧ���õ���������Ӧ�������Ͻ𣬹ʽ��ͺ���������NaOH��Һ��Ӧ�������壬��Ӧ�����ӷ���ʽΪ2Al+2OH��+2H2O=2AlO2��+3H2������3��A��Ũ������ʹ�������ۻ�������ʹ�Ͻ��ܽ⣬��A����B�����ý�����ϡ���ᷴӦ����������ܽ���ϡ�����У���B��ȷ��C��ϡ�����������Ӧ������Ⱦ�����壬�������ѡ��C����D��������NaOH��Һ��Ӧ�����ܽ�������ȫ���ܽ⣬��D����ѡB����1����������ϡ���ᷴӦ������������������ƶϳ���ԭ����ӦΪNH4�������������ϡ�����ᷴӦ�����ӷ���ʽΪ8Fe+30H��+3NO3���T8 Fe3��+3NH4��+9 H2O����2��BC�γ���������û�з����仯��ΪNH4NO3��NaOH��Ӧ�����ӷ���ʽΪNH4��+OH���TNH3��H2O������3��CD�η����ķ�Ӧ��Al��OH��3 +OH��=AlO2��+2H2O��n��NaOH��=0.002L��6mol��L��1=0.012mol����n��Al��OH��3��=0.012mol��������������Ԫ�ص����ʵ���Ϊ0.012mol����4����8Fe+30H��+3NO3���T8 Fe3��+3NH4��+9 H2O��8Al+30H��+3NO3���T8 Al3��+3NH4��+9 H2O��NH4��+OH���TNH3��H2O�ɵù�ϵʽ8��Fe��Al����3NH4����3OH����BC�����ĵ�OH�������ʵ���Ϊ6mol��L-1����42-39����10-3L=0.018mol����Fe��Al�����ʵ���֮��Ϊ0.018mol��8/3=0.048mol������B���Ӧ�ij���Fe��OH��3��Al��OH��3�����ʵ���Ϊ0.048mol��AB�����ĵ�����������Һ���ʵ���Ϊ0.048mol��3=0.144mol��AB�����ĵ��������Ƶ����Ϊ0.144mol/6mol��L��1=0.024L=24ml������A���Ӧ������������Һ�����Ϊ39-24=15��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A. �ƺͼصĺϽ�����ڿ����ӷ�Ӧ�����Ƚ�����
B. ���ó���������ĵ�����������оƬ
C. ��ⱥ��ʳ��ˮ���Ƶû���ɫ������
D. �����ж�����������ҩ��ĺϳ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���2L���ܱ������У�X��Y��Z������������ʵ�����ʱ��仯��������ͼ��ʾ��

��1��д���÷�Ӧ�Ļ�ѧ����ʽ________________________________��
��2�����㷴Ӧ��ʼ��10s����X��ʾ�ķ�Ӧ������______________��
��3��������������˵��������Ӧ�ﵽƽ��״̬����______________��
a����X��Y�ķ�Ӧ����֮��Ϊ1��1
b�����������X�������������ֲ���
c��X��Y��Z��Ũ��֮��Ϊ1��1��2
��4������Ӧ�ﵽƽ��ʱ����Y��ʾ������Ӧ����v����Y������Z��ʾ���淴Ӧ����v����Z���Ĺ�ϵʽ��_________________��
��5��Ϊʹ�÷�Ӧ�ķ�Ӧ�������ɲ�ȡ�Ĵ�ʩ��_______��
a���ʵ������¶� b��������������� c������һ����Z
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������й���;�����ʵĶ�Ӧ��ϵ������ǣ� ��
���� | ��; | ���� | |
A | С�մ� | ���ڱ��Ƹ�� | С�մ�����Ӧ |
B | ������ | ����ұ���ѡ�ﯵȽ��� | ��������ǿ��ԭ�� |
C | �������� | ������Ư�ոѡ�֯�� | SO2�ܸ����е���ɫ���ʽ�� |
D | ���� | ����ʳƷ�е������� | Fe���л�ԭ�� |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ���ʵ��̽��̼����Ԫ�صķǽ����Ե����ǿ��������Ҫ��������и��⣺
��1��ʵ��װ�ã�
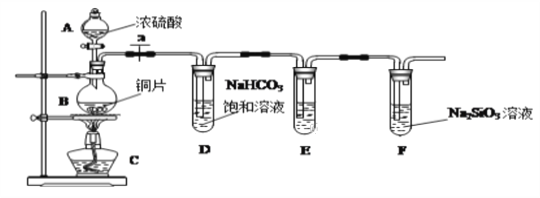
��д��ʾ�������ƣ�B__________
��2��ʵ�鲽�裺
����������_____________����ҩƷ�� a��Ȼ�����Ũ���ᣬ����
��3������̽��������֪����ǿ��:������>̼�ᣩ
��ͭ��Ũ���ᷴӦ�Ļ�ѧ����ʽ��________________________________��װ��E������KMnO4��Һ��������_____________________________��
����˵��̼Ԫ�صķǽ����Աȹ�Ԫ�طǽ�����ǿ��ʵ��������__________________���Թ�F�з�����Ӧ�����ӷ���ʽΪ_____________________��
�������Թ� D �еķ�Ӧ���ܷ�֤��S�ķǽ�����ǿ��C�ķǽ�����___���� ���ܡ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ˮ��ɽ���ǽ�ɽ��ɽ�����о�NO2��NO��CO��S02�ȴ�����Ⱦ���ˮ��Ⱦ��Ĵ����Խ��������й�������Ҫ���塣
(1)��֪�� ��NO2+CO![]() CO2+NO�÷�Ӧ��ƽ�ⳣ��ΪK1(��ͬ)��ÿ1mol�������ʷֽ�Ϊ��̬��̬ԭ�����յ������ֱ�Ϊ
CO2+NO�÷�Ӧ��ƽ�ⳣ��ΪK1(��ͬ)��ÿ1mol�������ʷֽ�Ϊ��̬��̬ԭ�����յ������ֱ�Ϊ
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
��N2(g)+O2(g) ![]() 2NO(g) ��H=+179.5kJ/mol K2
2NO(g) ��H=+179.5kJ/mol K2
��2NO(g)+O2(g)![]() 2NO2(g) ��H=-112.3kJ/mol K3
2NO2(g) ��H=-112.3kJ/mol K3
д��NO��CO��Ӧ��������Ⱦ������Ȼ�ѧ����ʽ____________________________________�����Ȼ�ѧ����ʽ��ƽ�ⳣ��K=_________(��K1��K2��K3��ʾ)��
(2)������ɱ�ĺ�ѹ(p��)�ܱ������г���1molCO2 ��������̼�����䷢����Ӧ�� C(s)+ CO2(g)![]() 2CO(g) ��H>0��ƽ��ʱ����ϵ����������������¶ȵĹ�ϵ����ͼ��ʾ��
2CO(g) ��H>0��ƽ��ʱ����ϵ����������������¶ȵĹ�ϵ����ͼ��ʾ��
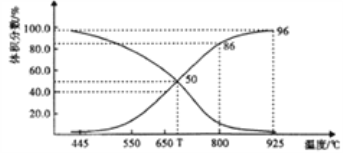
��T��ʱ����������������ϡ�����壬v(��)___v(��)(�>����<����=")��ƽ��______�ƶ�(���������������ͬ)��������������CO2 ��CO��ƽ��________�ƶ���
��CO�������Ϊ40%ʱ��CO2 ��ת����Ϊ_______��
����֪�������ѹ(p��)=������ѹ�������������ƽ���ѹ����ƽ��Ũ�ȱ�ʾƽ��Kp�����ı���ʽΪ__________��925��ʱ��Kp=______(�ú�p���Ĵ���ʽ��ʾ)��
(3)ֱ���ŷź�SO2 ���������γ����꣬Σ������������NaOH���գ����ú������(H2SO3��HSO3-��SO32-)�����ڷ�Ӧ�����Һ�У����ǵ����ʵ�������X(i)����ҺpH�Ĺ�ϵ��ͼ��ʾ��

������0.1mol/LNaOH ��Ӧ�����Һ�������Һ��pH=8ʱ����Һ�и�����Ũ���ɴ�С��˳����______________��
����pH=5��NaHSO3��Һ�еμ�һ��Ũ�ȵ�CaCl2 ��Һ����Һ�г��ֻ��ǣ�pH��Ϊ2���û�ѧƽ���ƶ�ԭ��������ҺpH���͵�ԭ��_______________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ�Ǿ����Դ���⣬�Ӻ�ˮ����ȡʳ�κ���Ĺ�����ͼ1�� 
��1�����оٺ�ˮ���������ַ������� ��
��2������I�м����Br2 �� ����II���ֽ�Br2��ԭΪBr�� �� ��Ŀ���� ��
��3������II��SO2ˮ��Һ����Br2 �� �����ʿɴ�95%���йط�Ӧ�����ӷ���ʽΪ ��
��4��ij��ѧ�о���ѧϰС��Ϊ���˽�ӹ�ҵ�����ᴿ��ķ������������й�����֪��Br2�ķе�Ϊ59�森����ˮ���ж�����ǿ��ʴ�ԣ����Dzι��������̺�����ͼ2װ�ü�ͼ�� 
�������������ۣ�
��ͼ������B�������� ��
������ʵ��װ�����������Ӿ��������������ܣ���ԭ���� ��
��ʵ��װ�����������ã�Ҫ�ﵽ�ᴿ���Ŀ�ģ���������ο��ƹؼ������� ��
��C��Һ����ɫΪ �� Ϊ��ȥ�ò������Բ���������Cl2 �� �������м���NaBr����Һ����ַ�Ӧ���ٽ��еķ�������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ��Cl-��Br-��I- �������ʵ���֮����1��2��3��ͨ��һ������Cl2 ������Ӧ��ɺñ�ֵ��Ϊ3��2��1����Ӧ��Cl2��ԭ��Һ��I-�����ʵ���֮����
A. 1��2 B. 1��4 C. 1��3 D. 1��6
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com