
【题目】某溶液中Cl-、Br-、I- 三者物质的量之比是1∶2∶3,通入一定量的Cl2 ,当反应完成后,该比值变为3∶2∶1,则反应的Cl2与原溶液中I-的物质的量之比是
A. 1∶2 B. 1∶4 C. 1∶3 D. 1∶6
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:
【题目】A是来自石油的重要有机化工原料,此物质可以用来衡量一个国家石油化工发展水平。E是具有果香味的有机物,D能与碳酸钠反应产生气体,F是一种高聚物,可制成多种包装材料。
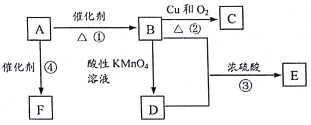
(1)A的结构式为___________。
(2)C分子中的官能团名称是_________,验证C物质存在该官能团的试剂是__________,现象为_________________________。
(3)写出下列反应的化学方程式并指出反应类型:
①____________________________:反应类型是______________;
③____________________________;反应类型是______________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝热反应是铝的一个重要性质,该性质用途十分广泛.“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”“纸漏斗的下部被烧穿,有熔融物落入沙中”.已知:Al、Al2O3、Fe、Fe2O3的熔点、沸点数据如表:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2 054 | 1 535 | 1 462 |
沸点/℃ | 2 467 | 2 980 | 2 750 | - |
I.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金.理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金.你认为他的解释是否合理? ______ (填“合理”或“不合理”).
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝,反应的离子方程式为 ______ .
(3)实验室溶解该熔融物,在下列试剂中最适宜的试剂是 ______ (填序号).
A、浓硫酸B、稀硫酸 C、稀硝酸D、氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入6molL-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:
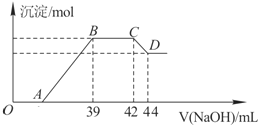
(1)依题意,请写出熔融物中铁与该稀的硝酸反应的离子方程式: ______
(2)在BC段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为 ______ ;
(3)熔融物中铝元素的物质的量为 ______ mol.
(4)B点对应的沉淀的物质的量为 ______ mol,A点对应的氢氧化钠溶液的体积为 ______ mL.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用A、B、C、D、E和F表示含有10个电子的微粒(离子或分子),请回答:
(1)A离子为单核离子且A原子在所在周期中原子半径最大,A离子是
(2)C是由两种元素组成的分子,其水溶液呈碱性,其分子式是
(3)D是由两种元素组成的三原子分子,电子式是
(4)向B中加入F先出现白色沉淀继续加入F沉淀溶解,写出该过程的离子方程式
(5)E+F→C+D写出该方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2SO3+I2+H2O == H2SO4+2HI,将0.1mol Cl2通入100mL含等物质的量的HI与H2SO3的混合溶液中,有一半的HI被氧化,则下列说法正确的是
A. 物质的还原性:HI>H2SO3>HCl
B. H2SO3的物质的量浓度为0.6 mol·L-1
C. 若再通入0.05mol Cl2,恰好能将HI和H2SO3完全氧化
D. 通入0.1mol Cl2发生反应的离子方程式为:5Cl2+4H2SO3+2I-+4H2O == 4SO42-+I2+10Cl-+16H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数的递增的八种短周期元素(用字母X表示)原子半径的相对大小、最高正价或最低负价的变化如图所示. 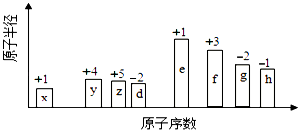
根据判断出的元素回答问题:
(1)f 在元素周期表的位置是;g的离子结构示意图为 .
(2)在z、d、e、f 四种元素中,其离子半径按由大到小的排列顺序为(用 化学式表示,下同);比较g、h的最高价氧化物对应的水化物的酸性较强的是: .
(3)由x和z元素组成一种四原子共价化合物,写出其电子式 .
(4)由x、z、h三种元素构成的盐,其水溶液显酸性,用离子方程式解释其原因 .
(5)已知1mol e 的单质在足量d2中燃烧,恢复至室温,放出255.5kJ热量,写出该反应的热化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在室温下,下列关于电解质的说法中正确的是
A. 中和等体积、等浓度的氨水和氢氧化钠溶液至pH=7,前者消耗的盐酸多
B. 向NH4Cl溶液中加入少量等浓度的稀盐酸,则![]() 的值减小
的值减小
C. 向NaHS溶液中加入适量 KOH 后:c(Na+)=c(H2S)+c(HS-)+c(S2-)
D. 将a mol·L-1的醋酸与0.01 mol·L-1的氢氧化钠溶液等体积混合(忽略体积、温度变化),所得溶液中c(Na+)=c(CH3COO-),则醋酸的电离常数Ka=![]() (用含a的代数式表示)
(用含a的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫和钙的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)基态Ca原子中,核外电子占据最高能层的符号是________,该能层为次外层时最多可以容纳的电子数为_________。元素Ca和S相比,第一电离能较大的是______(填元素符号)。
(2)钙元素的焰色反应呈砖红色,其中红色对应的辐射与钾元素的焰色反应对应颜色的辐射波长,较短的是_______(填元素符号)。
(3)H2S和H2O分子构型都为V形,中心原子的杂化形式都是______,但H2O分子键角大于H2S分子,原因是________________。
(4)钙元素和锰元素属于同一周期,且核外最外层电子构型相同,但金属钙的熔点、沸点等都比金属锰低,原因是________________。
(5)Ca、Mn、Mg的氧化物和硫化物都具是NaCl型结构的离子晶体,其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得它们的晶胞参数如下表:
氧化物晶体 | MgO | MnO | CaO |
a/nm | 0.421 | 0.444 | 0.480 |
硫化物晶体 | MgS | MnS | CaS |
a/nm | 0.520 | 0.520 | 0.568 |
由表可知:r(S2-)____r(O2-)(填“>”或“<”),r(Mg2+)、r(Ca2+)、r(Mn2+)由大到小的的顺序是__________,r(S2- )为_____nm,r(Ca2+)为_____nm。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com