
【题目】有机物M(C6H4S4)是隐形飞机上吸波材料的主要成分。某化学兴趣小组为探究其组成和分子结构,进行如下实验:
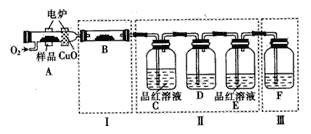
(1)将少量样品放入燃烧管A中,通入足量O2,用电炉加热使其充分燃烧,并将燃烧产物依次通入余下装置(夹持仪器的装置已略去)。
①写出A中样品燃烧的化学方程式______。
②装置B的目的是验证有机物中含氢元素,则B中盛装的试剂可为______。
③D中盛放的试剂是______(填序号)。
a.NaOH溶液b.品红溶液c.KMnO4溶液d.饱和石灰水
④装置A中燃烧管放入CuO的作用是______。
⑤指出装置F的错误______。
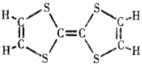
(2)M的结构简式如图所示,4.08g M可使_____mol氢气发生反应,同样质量的M完全燃烧需要消耗氧气_____mL(标准状况)。
【答案】C6H4S4+11O2![]() 6CO2+4SO2+2H2O 无水硫酸铜 c 将有机物中碳元素全部转化为二氧化碳 试剂瓶未与空气相通 0.06 4928
6CO2+4SO2+2H2O 无水硫酸铜 c 将有机物中碳元素全部转化为二氧化碳 试剂瓶未与空气相通 0.06 4928
【解析】
(1)①M为C6H4S4,则其燃烧产物有CO2、H2O、SO2,据此写出化学方程式;
②燃烧后,H元素存在于H2O中,检验H2O用无水CuSO4粉末;
③燃烧产物中有SO2,则C中的品红溶液是为了检验燃烧产物中SO2,D是为了除去SO2,E中的品红溶液是为了检验SO2是否被完全除去,依此选择D中的试剂;
④有机物燃烧也可能会生成CO,而实验装置中并没有针对CO的处理装置,所以CuO的作用是:将有机物中碳元素全部转化为二氧化碳;
⑤F的作用是检验CO2,则F中的溶液为澄清石灰水,该装置错误之处是没有和空气连通,因为澄清石灰水不可能完全吸收CO2,多余的CO2要排放到空气中,若F未与空气连通,则可能是装置内压强增大,瓶塞极有可能喷起,不符合实验安全规则;
(2)根据M的分子式可得M(M)=204g/mol,n(M)=0.02mol,再进行相关计算。
(1)①M为C6H4S4,则其燃烧产物有CO2、H2O、SO2,则其燃烧的化学方程式为C6H4S4+11O2![]() 6CO2+4SO2+2H2O;
6CO2+4SO2+2H2O;
②燃烧后,H元素存在于H2O中,检验H2O用无水CuSO4,故B中应装无水CuSO4;
③燃烧产物中有SO2,则C中的品红溶液是为了检验燃烧产物中SO2,D是为了除去SO2,E中的品红溶液是为了检验SO2是否被完全除去;
a、不能使用NaOH溶液,因为CO2还未被检验,如果使用NaOH溶液,CO2会被吸收,无法检验,a不合理;
b、品红溶液只能用来检验SO2,不能用来除去SO2,b不合理;
c、KMnO4溶液可以用来吸收SO2,不吸收CO2,c合理;
d、澄清石灰水常用来检验CO2,在某些情况下也可以检验SO2,澄清石灰水会同时吸收SO2和CO2,d不合理;
故选c;
④有机物燃烧也可能会生成CO,而实验装置中并没有针对CO的处理装置,所以CuO的作用是:将有机物中碳元素全部转化为二氧化碳;
⑤F的作用是检验CO2,则F中的溶液为澄清石灰水,该装置错误之处是没有和空气连通;
(2)M(M)=204g/mol,n(M)=![]() =0.02mol,1个M分子中含有3个碳碳双键,则0.02molM可以和0.06mol H2反应;根据M的燃烧方程式可以推出0.02mol M燃烧消耗0.22mol O2,其标准状况下的体积为4.928L,即4928mL。
=0.02mol,1个M分子中含有3个碳碳双键,则0.02molM可以和0.06mol H2反应;根据M的燃烧方程式可以推出0.02mol M燃烧消耗0.22mol O2,其标准状况下的体积为4.928L,即4928mL。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
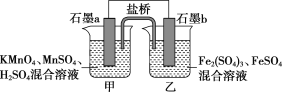
【题目】某研究性学习小组根据反应2KMnO4+10FeSO4+8H2SO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为1 mol·L-1,溶液的体积均为200 mL,盐桥中装有饱和K2SO4溶液。
回答下列问题:
(1)此原电池的正极是石墨________(填“a”或“b”),发生________反应。
(2)电池工作时,盐桥中的SO42-移向________(填“甲”或“乙”)烧杯。
(3)两烧杯中的电极反应式分别为
甲__________________________________________________________________;
乙________________________________________________________________。
(4)若不考虑溶液的体积变化,MnSO4浓度变为1.5 mol·L-1,则反应中转移的电子为____mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是
A.相同条件下,体积相等的CO气体和CO2气体它们所含的氧原子数目之比为1:1
B.同体积、同密度的N2O和CO2,两种气体的分子数一定相等
C.1mol钠与氧气反应生成Na2O或Na2O2时,失电子数目均为2NA
D.1L0. 45 mol/L NaCl溶液中Cl-的物质的量浓度比0.1L0. 15 mol/L AlCl3溶液大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2008年,三鹿等多家乳制品企业为使蛋白质含量检测合格而加入三聚氰胺,使多名儿童患肾结石,实验室可用下列实验装置测定三聚氰胺的分子式。

已知三聚氰胺的相对分子质量为126。取1.26 g三聚氰胺样品,放在纯氧中充分燃烧,生成二氧化碳、水、氮气,实验测得装置B增重0.54g,C增重1.32g,排入F中水的体积为672 mL(可按标准状况计算)。
(1)E装置的作用是_____。
(2)需要加热的装置是____(填字母代号)。
(3)装置D的作用是_____。
(4)F处读数时应该注意的是____、_____。
(5)三聚氰胺的分子式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空。
(1)根据反应Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,氧化剂与还原剂的物质的量之比是_____,当有2molHNO3参加反应时,被氧化的物质是____g,电子转移数目约为_____个。
(2)在反应K2S+4H2SO4(浓)![]() K2SO4+4SO2↑+4H2O中,氧化产物是____,还原产物是______,氧化剂与还原剂物质的量之比是_____。
K2SO4+4SO2↑+4H2O中,氧化产物是____,还原产物是______,氧化剂与还原剂物质的量之比是_____。
(3)某同学写出以下三个化学方程式:(未配平)
①NO+HNO3→N2O3+H2O
②NH3+NO→HNO2+H2O
③N2O4+H2O→HNO3+HNO2
其中你认为不可能实现的是______。
(4)今有下列三个氧化还原反应:
①2FeCl3+2KI=2FeCl2+2KCl+I2
②2FeCl2+Cl2=2FeCl3
③2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
氧化性最强的物质的是____(填字母,下同),若某溶液中有Fe2+、I-、Cl-共存,要将I-氧化除去而不氧化Fe2+和Cl-,则可加入的试剂是____。
A.Cl2 B.KMnO4 C.FeCl3 D.I2
(5)30mL浓度为0.05mol·L-1的Na2SO3溶液恰好与25mL浓度为0.02mol·L-1的K2R2O7溶液反应,则元素R在还原产物中的化合价是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。

根据判断出的元素回答问题:
(1)f在周期表中的位置是____________。
(2)比较d、e常见离子的半径大小(用化学式表示,下同):________>________;比较g、h的最高价氧化物对应水化物的酸性强弱:____________>____________。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式:________________________。
(4)写出e的单质在空气中燃烧所得产物的电子式:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年2月27日,科技日报报道中科院大连化学物理研究所创新性地提出锌碘单液流电池的概念,锌碘单液流电池中电解液的利用率达到近100%,进而大幅度提高了电池的能量密度,工作原理如图所示。下列说法不正确的是( )
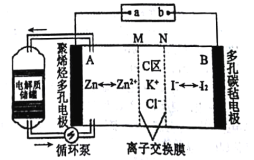
A.该电池放电时电路中电流方向为B→b→a→A
B.M为阴离子交换膜,N为阳离子交换膜
C.如果使用铅蓄电池进行充电,则a电极应连接铅蓄电池中的Pb电极
D.若充电时C区增加的离子数为2NA,则A极增重65g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以“物质的量”为中心的计算是化学计算的基础,下列与“物质的量”相关的计算正确的是( )
A.现有CO、CO2、O3三种气体,它们分别都含有1 mol O,则三种气体的物质的量之比为3∶2∶1
B.5.6 g CO和22.4 L CO2中含有的碳原子数一定相等
C.标准状况下,11.2 L X气体分子的质量为16 g,则X气体的摩尔质量是32
D.a g Cl2中有b个氯原子,则阿伏加德罗常数NA的数值可表示为35.5b/a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铁和铁粉的混合物19.2 g,恰好溶于150 mL某浓度的稀硫酸,并收集到3.36 L(标准状况下)的气体.向反应后的溶液中滴加硫氰化钾溶液,不显血红色.求:
(1)与稀硫酸反应的铁的物质的量.___________
(2)稀硫酸的物质的量浓度._____________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com