
利用制取硫酸产生的矿渣(主要成分为Fe2O3、Fe3O4、FeO、Al2O3及SiO2等)制备高纯氧化铁(α-Fe2O3)的工艺流程如下: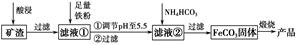
(1)“酸浸”过程中Fe3O4发生反应的离子方程式为______________________________。为提高“酸浸”中铁元素的浸出率,除了采用合适的液固比和循环浸取外,适宜的条件还有____________________、____________________。(任举两例)
(2)调节pH至5.5的目的是______________________________________。
(3)滤液②中加入NH4HCO3时需要控制反应温度不能过高,原因是__________________________________________________。(答一点即可)
(4)在空气中煅烧FeCO3制备高纯氧化铁的化学方程式为_______________________________________________________。
 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:填空题
明矾石经处理后得到明矾[KAl(SO4)2·12H2O]。从明矾制备Al、K2SO4、和H2SO4的工艺过程如下所示: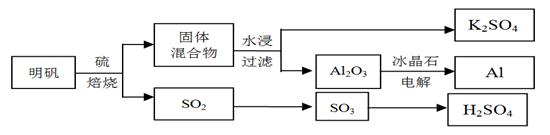
焙烧明矾的化学方程式为:4KAl(SO4)2·12H2O + 3S = 2K2SO4 + 2Al2O3 + 9SO2 + 48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,还原剂是 。
(2)从水浸后的滤液中得到K2SO4晶体的方法是 。
(3)Al2O3在一定条件下可制得AlN,其晶体结构如图所示,该晶体中Al的配位数是 。
(4)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池反应的化学方程式是 。
(5)焙烧产生的SO2可用于制硫酸。已知25℃、101kPa时:
2SO2(g)+ O2(g) 2SO3(g) △H1 = -197 kJ /mol;
2SO3(g) △H1 = -197 kJ /mol;
H2O(g) H2O(l) △H2 = -44 kJ/mol;
H2O(l) △H2 = -44 kJ/mol;
2SO2(g)+ O2(g)+ 2H2O(g)=2H2SO4(aq) △H3 = -545 kJ/mol。
则SO3(g)与H2O(l)反应的热化学方程式是 。
焙烧948 t明矾(M =" 474" g/mol),若SO2的利用率为96%,可产生质量分数为98%的硫酸 t。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
A、B、C三种物质中均含有同一种元素,它们之间有如下图所示的转化关系(部分反应物已略去)。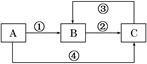
(1)若A是一种两性氧化物,B的水溶液呈酸性,请写出反应①和反应④(由A一步转化为B或C)的离子方程式:反应①______________________________________;
反应④_______________________________________________________。
(2)若反应①为置换反应,反应④为化合反应,C物质大量存在于海水中,是人体生理活动不可缺少的物质。工业上可以用C来制取A或B,请写出这两个反应的化学方程式:C→A________________________________________________________________________;
C→B_______________________________________________________________;
(3)若反应①②③均为化合反应,反应④为置换反应。当A为一种金属单质时,请写出反应②和③可能的离子方程式:②_____________________________________________;
③_____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
工业上以钛铁矿为原料制备二氧化钛的工艺流程如下图所示。钛铁矿的主要成分为钛酸亚铁(FeTiO3),其中一部分铁元素在风化过程中会转化为+3价。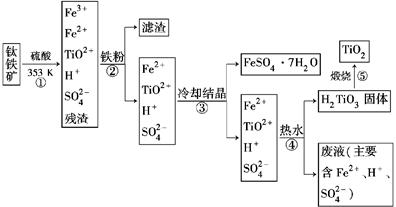
已知:TiOSO4遇水会水解。
(1)步骤②中,用铁粉将Fe3+转化为Fe2+的离子方程式为_______________________
(2)步骤③中,实现混合物的分离是利用物质的________(填字母序号)。
a.熔、沸点差异 b.溶解性差异 c.氧化性、还原性差异
(3)步骤②、③、④中,均需要进行的操作是________(填操作名称)。
(4)请结合化学用语用化学平衡理论解释步骤④中将TiO2+转化为H2TiO3的原理:
____________________________________________________________。
(5)利用生产过程中的废液与软锰矿(主要成分为MnO2)反应可生产硫酸锰(MnSO4,易溶于水),该反应的离子方程式为__________________________________
(6)研究发现,用石墨作阳极、钛网作阴极、熔融CaF2-CaO作电解质,利用如图所示装置可获得金属钙,并可以钙为还原剂,还原二氧化钛制备金属钛。
写出阳极的电极反应式:_________________________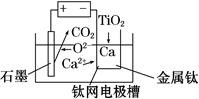
在制备金属钛前后,CaO的总量不变,其原因是______________________________________(请结合化学用语解释)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知A~G有如图所示的转化关系(部分生成物已略去),其中A、G为单质,D是能使湿润的红色石蕊试纸变蓝色的气体,E、F均能与NaOH溶液反应。
请回答下列问题:
(1)写出F的电子式:____________。
(2)①C溶液与D反应的离子方程式为________________________________________________________________________________________________________________________________________________;
②F溶液与NaOH溶液共热反应的化学方程式为________________________________________________________________________________________________________________________________________________。
(3)①请用离子方程式解释C溶液为何显酸性:________________________________________________________________________________________________________________________________________________,
②F溶液中离子浓度由大到小的顺序为________________________________________________________________________。
(4)将5.4 g A投入200 mL 2.0 mol/L某溶液中有G单质产生,且充分反应后有金属剩余,则该溶液可能是________(填代号)。
A.HNO3溶液 B.H2SO4溶液 C.NaOH溶液 D.HCl溶液
(5)将1 mol N2和3 mol G及催化剂充入容积为2 L的某密闭容器中进行反应,已知该反应为放热反应。平衡时,测得D的物质的量浓度为a mol/L。
①如果反应速率v(G)=1.2 mol/(L·min),则v(D)=________mol/(L·min)。
②在其他条件不变的情况下,若起始时充入0.5 mol N2和1.5 mol G达到平衡后,D的物质的量浓度________(填“大于”“小于”或“等于”) mol/L。
mol/L。
③该条件下的平衡常数为__________________(用含a的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某探究小组将一批废弃的线路板简单处理后,得到含70%Cu、25%Al、4%Fe及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线: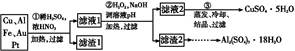
请回答下列问题:
(1)第①步Cu与酸反应的离子方程式为 。
(2)第②步加H2O2的作用是 ;
调溶液pH的目的是使 生成沉淀。
(3)用第③步所得CuSO4·5H2O制备无水CuSO4的方法是 。
(4)由滤渣2制取Al2(SO4)3·18H2O ,探究小组设计了三种方案: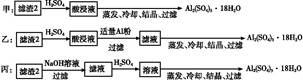
上述三种方案中, 方案不可行,原因是 ;
从原子利用率角度考虑, 方案更合理。
(5)探究小组用滴定法测定CuSO4·5H2O含量。取a g试样配成100 mL溶液,每次取20.00 mL,消除干扰离子后,用c mol /L EDTA(H2Y2-)标准溶液滴定至终点,平均消耗EDTA溶液b mL。滴定反应如下:Cu2++H2Y2- CuY2-+2H+。写出计算CuSO4·5H2O质量分数的表达式w= ;
CuY2-+2H+。写出计算CuSO4·5H2O质量分数的表达式w= ;
下列操作会导致CuSO4·5H2O含量的测定结果偏高的是 。
a.未干燥锥形瓶
b.滴定终点时滴定管尖嘴中产生气泡
c.未除净可与EDTA反应的干扰离子
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知少量碳酸钠与足量盐酸反应,有二氧化碳气体放出;而少量盐酸与过量碳酸钠反应,则生成碳酸氢钠和氯化钠,无气体放出。现有A、B两瓶无色溶液,其中一瓶是稀盐酸,另一瓶是碳酸钠溶液。为测定两瓶溶液的成分及物质的量浓度,进行以下实验:
①取20mLA溶液,向其中缓慢滴入B溶液25mL,共收集到112mL(标准状况)气体。
②取25mLB溶液,向其中缓慢滴入A溶液20mL,共收集到56mL(标准状况)气体。
(1)写出少量盐酸与过量碳酸钠反应,无气体放出的离子方程式 ;
(2)为使上述①②反应完全,还需加入 ;(填“稀盐酸”或“碳酸钠溶液”)A溶液的物质的量浓度为 mol·L -1。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:
已知2Na2SiO3+2NaAlO2+2H2O Na2Al2Si2O8↓+4NaOH,请回答下列问题:
Na2Al2Si2O8↓+4NaOH,请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的离子方程式为 。
(2)流程乙加入烧碱后Al2O3发生反应的离子方程式为 。
(3)固体X的主要成分是 ,过滤时使用的玻璃棒,其作用是 。
(4)滤液B中溶质的主要成分是 (填化学式);滤液E、K中溶质的主要成分是 (填化学式),写出该溶液的一种用途 。
(5)在流程中,选用CO2作酸化剂,为什么不选用盐酸? 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
铁是人类生产和生活中必不可少的重要金属。
(1)自然界一共存在四种稳定的铁原子,分别是54Fe、56Fe、57Fe和58Fe,其中58Fe原子中子数与质子数之差为___________。
计算铁元素的近似相对质量的计算式为:54×a1%+56×a2%+57×a3%+58×a4%,其中a1%、a2%……是指各同位素的____________________。
(2)铁原子中有______种能量不同的电子,铁原子次外层的电子云有_____种不同的伸展方向。
(3)与铁同周期的主族元素中,最高价氧化物对应水化物中,碱性最强的化合物与酸性最强的化合物的化学反应方程式为________________________________。
(4)要用铁片、锌片、直流电源和导线完成铁片镀锌的实验,铁片应置于_________极,电解质溶液是____________________。
(5)高铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原为Fe3+,配平制取高铁酸钠的化学方程式:
___Fe(NO3)3 + ___NaOH + ___Cl2 →___Na2FeO4 + ___NaNO3 + ___NaCl + ___H2O
高铁酸钠除了能消毒杀菌外,还能吸附水中的悬浮物,其原因是______________________。
(6)0.03mol的铁加到过量的HNO3中,加热,铁完全溶解,若生成NO、NO2的混和气体共1.12L(标准状况)。将盛有此气体的容器倒扣在水中,通入标准状况下一定体积的O2,恰好使气体全部溶于水生成HNO3,则通入O2的体积________________L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com