
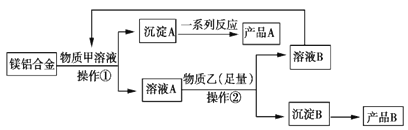
【题目】MgO、Al2O3都是常用的耐火材料,某研究小组取100 kg含60%Al的报废汽车的镁合金材料来制备MgO、Al2O3,其中物质甲可由溶液B转化再生,其工艺流程如图所示。
请回答下列问题:
(1)下列说法正确的是__________(填字母)。
A.合金是金属与金属熔合而成的混合物
B.合金的熔点比成分金属更高
C.合金的硬度等机械性能优于成分金属
D.氧化铝熔点高,故可以用氧化铝坩埚熔融氢氧化钠
(2)物质甲是________________,产品A是________________。
(3)操作②为____________。
(4)足量物质乙与溶液A发生反应的离子方程式为___________________________。
(5)假设不计损耗,可得产品B的质量为__________kg。(保留一位小数)
【答案】C NaOH MgO 过滤 AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- 113.3
【解析】
镁铝合金材料经过物质甲溶液后,得到沉淀和溶液,所以甲是氢氧化钠溶液,沉淀A是镁,溶液A是氢氧化钠和偏铝酸钠的混合溶液,所以产品A是氧化镁,物质乙是二氧化碳,过量二氧化碳与混合液反应生成碳酸氢钠溶液,则溶液B是碳酸氢钠溶液,沉淀B是氢氧化铝,所以产品B是氧化铝,据此分析即可。
(1)A.合金不一定是金属和金属的混合物,错误;
B.合金的熔点比成分金属的熔点低,错误;
C.合金的硬度等机械性能一般优于成分金属,正确;
D.氧化铝的熔点高,可作为坩埚,但氧化铝能与强碱反应,不能用于熔融氢氧化钠,错误;
(2)Al与NaOH溶液反应,而Mg不与NaOH溶液反应,将镁铝合金投入NaOH溶液中,完全反应后过滤得到固体Mg和NaAlO2溶液,沉淀A为Mg,Mg与酸反应得Mg2+,Mg2+与碱溶液反应生成Mg(OH)2,加热Mg(OH)2得产品A(MgO)。沉淀B为Al(OH)3,加热Al(OH)3得到产品B(Al2O3);
(3)操作②为固液不相溶分离,故该操作为过滤;
(4)向NaAlO2溶液中通入过量的CO2,得到Al(OH)3沉淀和NaHCO3,其反应的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;
(5)100 kg合金中含有60 kg Al,根据铝元素守恒,最终可得Al2O3的质量=(60kg×102g/mol)÷(2×27g/mol)≈113.3kg。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列装置能达到实验目的的是
A. 碳酸氢钠溶液直接蒸干得到碳酸氢钠固体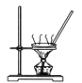
B. 制备Fe(OH)2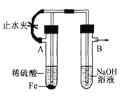
C. 除去CO2中含有的少量HCl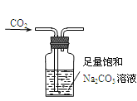
D. 配制100mL 0.1mol/L的稀硫酸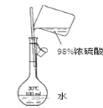
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]() 、
、![]()
I.冠心平F是降血脂、降胆固醇的药物,它的一条合成路线如下:
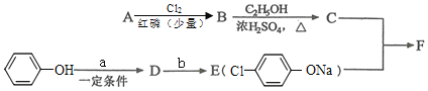
(1)A为一元羧酸,8.8gA与足量NaHCO3溶液反应生成2.24LCO2(标准状况),A的分子式为____________。
(2)写出符合A分子式的所有甲酸酯的结构简式:________________。
(3)B是氯代羧酸,其核磁共振氢谱有两个峰,写出B→C的反应方程式:____________。
(4)C+E→F的反应类型为____________。
(5)写出A和F的结构简式:____________。
(6)D的苯环上有两种氢,它所含官能团的名称为_____________;写出b所代表的试剂为____________。
II.有机物H的分子式为C2H2O3,可发生银镜反应,且具有酸性。
(7)H有多种合成方法,在方框中写出由乙酸合成H的路线流程图(其他原料任选)。合成路线流程图示例如下:![]() ________________________________________________。
________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为周期表中部分元素的某种性质(X值)随原子序数变化的关系。

(1)短周期中原子核外p轨道上电子数与s轨道上电子总数相等的元素是________(写元素符号)。
(2)同主族内不同元素的X值变化的特点是 ________________,同周期内,随着原子序数的增大,X值变化的总趋势是________。周期表中X值的这种变化特点体现了元素性质的____________变化规律。
(3)X值较小的元素集中在元素周期表的________。
a.左下角 b.右上角 c.分界线附近
(4)下列关于元素该性质的说法中正确的是________(选填代号)。
a.X值可反映元素最高正化合价的变化规律
b.X值可反映原子在分子中吸引电子的能力
c.X值大小可用来衡量元素金属性和非金属性的强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A为金属单质,它们之间能发生如下反应(部分产物未标出)
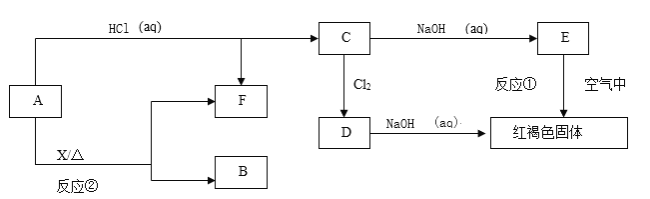
请根据以上信息回答下列问题:
(1)写出物质B、D的化学式:__________________、__________________ 。
(2)写出下列反应的化学方程式:
反应①____________________________________________________________ 。
反应②______________________________________________________________________。
(3)将B溶于盐酸完全反应,试写出反应的离子方程式:___________________________,为证明反应后溶液中浓度较低的金属离子的存在,操作为____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置进行相关实验,操作正确且能达到实验目的的是
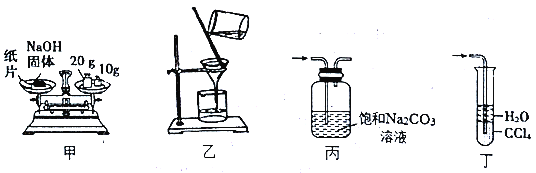
A. 甲装置:称30.0gNaOH固体 B. 乙装置:过滤除去溶液中的不溶性杂质
C. 丙装置:除去CO2中混有的HCl气体 D. 丁装置:吸收实验室制NH3的尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究氮及其化合物的性质,可以有效改善人类的生存环境。氮元素化合价一物质类别关系图如下。
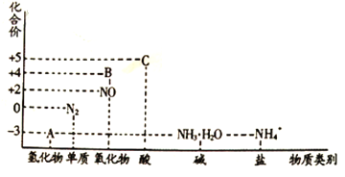
回答下列问题:
(1)在催化剂和加热的条件下,物质A生成NO是工业制硝酸的重要反应,化学方程式是_______________________________________________________________________________。
(2)在加热条件下,物质C的浓溶液与碳单质反应,写出反应的化学方程式______________。
(3)实验室中,检验溶液中含有NH4+的操作方法是______________。
(4)物质B为红棕色气体,写出该物质与水反应的离子方程式______________________,当反应消耗3.36L(标准状况)物质B时,转移电子的物质的量为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)CH、CH3、CH都是重要的有机反应中间体,它们的电子式分别是________、________、________;其中CH中四个原子是共平面的,三个键角相等,则键角应是________。
(2)叠氮化合物在化学工业上有重要应用。N叫做叠氮离子,请写出3种由三个原子构成的含有与N的电子数相同的粒子的化学式______、______、______。
(3)N≡N键的键能为946 kJ/mol,N—N键的键能为193 kJ/mol,说明N2中的________键比________键稳定(填“σ”或“π”)
(4)CaC2中C![]() 与O
与O![]() 互为等电子体,O
互为等电子体,O![]() 的电子式可表示为________________;1 mol O
的电子式可表示为________________;1 mol O![]() 中含有的π键数目为________。
中含有的π键数目为________。
(5)PH3在常温下是一种无色、剧毒、易自燃的气体,分子结构和NH3相似。在常温下1体积的水能溶解0.26体积的PH3,PH3和卤化氢(HX)作用生成相应的化合物PH4X,PH4X在水溶液中完全水解(PH结构类似于CH4)。PH3的分子结构的形状是________;在PH中P-H键之间的夹角是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)同主族的A、B两元素,已知A的原子序数为x,A和B所在周期包含元素的种数分别为m和n,如果A和B在第ⅠA族,当B在A的上一周期时,B的原子序数为________;当B在A的下一周期时,B的原子序数为________;如果A和B在第ⅦA族,当B在A的上一周期时,B的原子序数为________;当B在A的下一周期时,B的原子序数为________。
(2)已知R为ⅡA族元素,L为ⅢA族元素,它们的原子序数分别为m和n,且R、L为同一周期元素,下列关系式错误的是(____)
A.n=m+1 B.n=m+10 C.n=m+11 D.n=m+25
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com