
【题目】(1)CH、CH3、CH都是重要的有机反应中间体,它们的电子式分别是________、________、________;其中CH中四个原子是共平面的,三个键角相等,则键角应是________。
(2)叠氮化合物在化学工业上有重要应用。N叫做叠氮离子,请写出3种由三个原子构成的含有与N的电子数相同的粒子的化学式______、______、______。
(3)N≡N键的键能为946 kJ/mol,N—N键的键能为193 kJ/mol,说明N2中的________键比________键稳定(填“σ”或“π”)
(4)CaC2中C![]() 与O
与O![]() 互为等电子体,O
互为等电子体,O![]() 的电子式可表示为________________;1 mol O
的电子式可表示为________________;1 mol O![]() 中含有的π键数目为________。
中含有的π键数目为________。
(5)PH3在常温下是一种无色、剧毒、易自燃的气体,分子结构和NH3相似。在常温下1体积的水能溶解0.26体积的PH3,PH3和卤化氢(HX)作用生成相应的化合物PH4X,PH4X在水溶液中完全水解(PH结构类似于CH4)。PH3的分子结构的形状是________;在PH中P-H键之间的夹角是_____。
【答案】 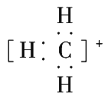
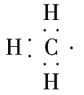
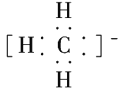 120° CO2 N2O BeF2 π σ
120° CO2 N2O BeF2 π σ ![]() 2NA 三角锥形 109.5°
2NA 三角锥形 109.5°
【解析】本题主要考查分子结构。
(1)CH、CH3、CH都是重要的有机反应中间体,它们的电子式分别是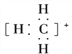 、
、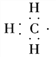 、
、 ;其中CH中四个原子是共平面的,三个键角相等,则键角应是120°。
;其中CH中四个原子是共平面的,三个键角相等,则键角应是120°。
(2) N含有22个电子,3种由三个原子构成的含有与N的电子数相同的粒子的化学式为CO2、N2O、BeF2。
(3)N≡N键的键能为946 kJ/mol,N—N键的键能为193 kJ/mol,946>193×3=579,说明N2中的π键比σ键稳定。
(4)CaC2中C![]() 与O
与O![]() 互为等电子体,O
互为等电子体,O![]() 的电子式与C
的电子式与C![]() 相似,可表示为
相似,可表示为![]() ;1 mol O
;1 mol O![]() 中含有的π键数目为2NA。
中含有的π键数目为2NA。
(5)PH3的分子结构和NH3相似,形状是三角锥形;在PH中P-H键之间的夹角是109.5°。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列实验操作正确且能达到相应目的的是
选项 | 实验目的 | 实验操作 |
A | 称取2.0gNaOH固体 | 先在托盘上各放1张滤纸,然后在右盘上添加2g砝码,左盘上添加NaOH固体 |
B | 配制稀硫酸 | 先将浓硫酸加入烧杯,后倒入蒸馏水 |
C | 验证铁的吸氧腐蚀 | 将铁钉放入试管中,用盐酸浸没 |
D | 检验溶液中是否有NH4+ | 取少量试液于试管中,加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MgO、Al2O3都是常用的耐火材料,某研究小组取100 kg含60%Al的报废汽车的镁合金材料来制备MgO、Al2O3,其中物质甲可由溶液B转化再生,其工艺流程如图所示。
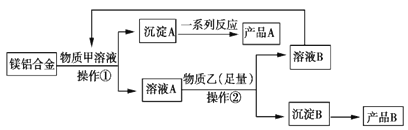
请回答下列问题:
(1)下列说法正确的是__________(填字母)。
A.合金是金属与金属熔合而成的混合物
B.合金的熔点比成分金属更高
C.合金的硬度等机械性能优于成分金属
D.氧化铝熔点高,故可以用氧化铝坩埚熔融氢氧化钠
(2)物质甲是________________,产品A是________________。
(3)操作②为____________。
(4)足量物质乙与溶液A发生反应的离子方程式为___________________________。
(5)假设不计损耗,可得产品B的质量为__________kg。(保留一位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用废镍催化剂(主要成分为Ni,还含有一定量的Zn、Fe、SiO2、CaO等)制备草酸镍晶体的流程如下:
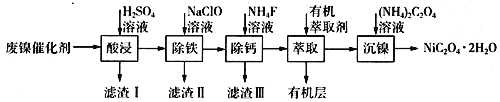
(1)请写出一种能提高“酸浸”速率的措施:________________________;滤渣I的成分是____________(填化学式)。
(2)除铁时,控制不同的条件可以得到不同的滤渣II。已知滤渣II的成分与温度、pH的关系如图所示:
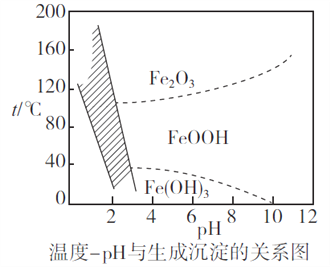
①若控制温度40℃、pH=8,则滤渣II的主要成分为_________________________(填化学式)。
②若控制温度80℃、pH=2,可得到黄铁矾钠[Na2Fe6(SO4)4(OH)12](图中阴影部分),写出生成黄铁矾钠的离子方程式:___________________________________________。
(3)已知除铁后所得100 mL溶液中c(Ca2+)=0.01mol·L-1,加入100 mL NH4F溶液,使Ca2+恰好沉淀完全即溶液中c(Ca2+)=1×10-5 mol·L-1,则所加c(NH4F)=_________mol·L-1。[已知Ksp(CaF2)=5.29×10-9]
(4)加入有机萃取剂的作用是________________________。
(5)某化学镀镍试剂的化学式为MxNi(SO4)y(M为+1价阳离子,Ni为+2价,x、y均为正整数)。为测定该镀镍试剂的组成,进行如下实验:
I.称量28.7g镀镍试剂,配制100 mL溶液A;
Ⅱ.准确量取10.00 mL溶液A,用0.40 mol·L-1的EDTA(Na2H2Y)标准溶液滴定其中的Ni2+(离子方程式为Ni2++H2Y2-=NiY2-+2H+),消耗EDTA标准溶液25.00mL;
Ⅲ.另取10.00 mL溶液A,加入足量的BaCl2溶液,得到白色沉淀4.66g。
①配制100 mL镀镍试剂时,需要的仪器除药匙、托盘天平、玻璃棒、烧杯、量筒、胶头滴管外,还需要________________________。
②该镀镍试剂的化学式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定质量的镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如右图。下列关于反应的说法错误的是
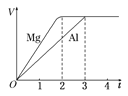
A.镁和铝的物质的量之比为3∶2
B.镁和铝转移电子数之比为1∶1
C.镁和铝的摩尔质量之比为8∶9
D.镁和铝反应所用时间之比为3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知和碳元素同主族的X元素位于元素周期表中的第一个长周期,短周期元素Y原子的最外层电子数比内层电子总数少3,它们形成化合物的分子式是XY4。试回答:
(1)X元素的原子基态时电子排布式为: ____________________________,
Y元素原子最外层电子的电子排布图为:____________________________。
(2)若X、Y两元素电负性分别为2.1和2.85,试判断XY4中X与Y之间的化学键为____(填“共价键”或“离子键”)。
(3)该化合物的空间结构为____,中心原子的杂化类型为____,分子为____(填“极性分子”或“非极性分子”)。
(4)该化合物在常温下为液体,该液体微粒间的作用力是____。
(5)该化合物的沸点与SiCl4比较:____(填化学式)的高,原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 加压有利于SO2与O2反应生成SO3 B. 500度左右比常温下更有利于合成氨
C. 将氨气液化,有利于合成氨的反应 D. 用过量空气煅烧硫铁矿可以提高原料利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物与人类生产、生活密切相关。
(1)氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体。
已知:CO(g)+NO2(g)=NO(g)+CO2(g) △H=-a kJ·mol-1(a>0)
2CO(g)+2NO(g)=N2(g)+2CO2(g) △H=-b kJ·mol-1(b>0)
若用CO还原NO2至N2,当消耗标准状况下3.36L CO时,放出的热量为___________kJ(用含有a和b的代数式表示)。
(2)在373K时,向体积为2L的恒容真空容器中通入0.40 mol NO2,发生反应:2NO2(g)![]() N2O4(g) △H=-57.0 kJ·mol-1。测得NO2的体积分数[
N2O4(g) △H=-57.0 kJ·mol-1。测得NO2的体积分数[![]() (NO2)]与反应时间(t)的关系如下表:
(NO2)]与反应时间(t)的关系如下表:

①0~20 min内,v(N2O4)=________mol·L-1·min-1。
②上述反应中,v(NO2)=k1·c2(NO2),v(N2O4)=k2·c(N2O4),其中k1、k2为速率常数,则373K时,k1、k2的数学关系式为_____________。改变温度至T1时k1=k2,则T1_________373K(填“>”、“<”或“=”)。
(3)连二次硝酸(H2N2O2)是一种二元弱酸。25℃时,向100 mL 0.1 mol·L-1H2N2O2溶液中加入V mL 0.1mol·L-1 NaOH溶液。(已知25℃时,连二次硝酸的Ka1=10-7,Ka2=10-12)
①若V=100,则所得溶液中c(H2N2O2)_____________c(N2O22-) (填“>”、“<”或“=”),通过计算解释原因____________________________________________________________。
②若V=200,则所得溶液中离子浓度由大到小的顺序为________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com