
【题目】碘及其化合物在合成杀菌剂、药物等方面具有广泛用途。回答下列问题:
(1)大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2。该反应的还原产物为______。
(2)已知反应2HI(g)![]() H2(g)+I2(g)的△H = +11 kJ·mol-1,l molH2(g)、1 mol I2(g)分子中化学键断裂时分别需要吸收436 kJ、151 kJ的能量,则1 mol HI(s)分子中化学键断裂时需吸收的能量为______kJ。
H2(g)+I2(g)的△H = +11 kJ·mol-1,l molH2(g)、1 mol I2(g)分子中化学键断裂时分别需要吸收436 kJ、151 kJ的能量,则1 mol HI(s)分子中化学键断裂时需吸收的能量为______kJ。
(3)Bodensteins研究了下列反应:2HI(g)![]() H2(g)+I2(g)。在716 K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
H2(g)+I2(g)。在716 K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
①根据上述实验结果,该反应的平衡常数K的计算式为__________________。
②上述反应中,正反应速率为![]() 正=k正x2(HI),逆反应速率为
正=k正x2(HI),逆反应速率为![]() 逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为____________________(以K和k正表示)。若k正=0.0027 min-1,在t = 40 min时,
逆=k逆x(H2)x(I2),其中k正、k逆为速率常数,则k逆为____________________(以K和k正表示)。若k正=0.0027 min-1,在t = 40 min时, ![]() 正 = _______________min-1。
正 = _______________min-1。
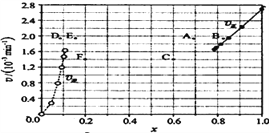
③由上述实验数据计算得到![]() 正~x(HI)和
正~x(HI)和![]() 逆~x(H2)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为______________(填字母)。
逆~x(H2)的关系可用下图表示。当升高到某一温度时,反应重新达到平衡,相应的点分别为______________(填字母)。
【答案】 MnSO4(或Mn2+) 299 ![]() k正/K 1.95×10-3 A、E
k正/K 1.95×10-3 A、E
【解析】(1)根据氧化还原反应方程式来判断还原产物是中学常规考法,迁移实验室制氯气的原理可得MnSO4。
(2) 键能一般取正值来运算,ΔH=E(反应物键能总和)-E(生成物键能总和);设1molHI(g)分子中化学键断裂时需吸收的能量为xkJ,代入计算:+11=2x-(436+151),x=299。
(3) ①因反应前后气体体积相等,不同的起始态很容易达到等效的平衡状态。表格中的两列数据是正向和逆向的两组数据。
716K时,取第一行数据计算:2HI(g)![]() H2(g)+I2(g)
H2(g)+I2(g)
n(始)(取1mol) 1 0 0
Δn(0.216) (0.108) (0.108)
n(平) 0.784(0.108) (0.108)
化学平衡常数为![]()
②平衡状态下,v正=v逆,故有:k正·x2(HI) =k逆·x(H2)·x(I2)
变形:k正/k逆={x(H2)·x(I2)}/x2(HI)=K;故有:k逆=k正/K
③注意到升温的两个效应(加快化学反应速率、使平衡移动)即可突破:先看图像右半区的正反应,速率加快,坐标点会上移;平衡(题中已知正反应吸热)向右移动,坐标点会左移。综前所述,找出A点。同理可找出E点。


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中通入X并发生反应:2X(g)![]() Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是
Y(g),温度T1、T2下X的物质的量浓度c(X)随时间t变化的曲线如图所示,下列叙述正确的是

A. 该反应进行到M点放出的热量大于进行到W点放出的热量
B. T2下,在0~t1时间内,υ(Y)=a-b/t1 mol/(L·min)
C. M点的正反应速率υ(正)大于N点的逆反应速率υ(逆)
D. M点时再加入一定量的X,平衡后X的转化率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了保护臭氧层,可采取的有效措施是( )
A. 减少二氧化硫的排放量 B. 减少含铅废气的排放量
C. 减少氟氯烃的排放量 D. 减少二氧化碳的排放量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合下表回答下列问题(均为常温下的数据):
酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
CH3COOH | 1.8×10-5 | H2CO3 | K1=4.4×10-7 K2=4.7×10-11 | H2C2O4 | K1=5.4×10-2 K2=5.4×10-5 | H2S | K1=1.3×10-7 K2=7.1×10-15 |
HClO | 3×10-8 |
请回答下列问题:
Ⅰ.(1)同浓度的CH3COO-、HCO、CO![]() 、HC2O4- 、ClO-、S2-结合H+的能力最弱的____________。
、HC2O4- 、ClO-、S2-结合H+的能力最弱的____________。
(2)常温下0.1 mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的
是________(填序号)。
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)·c(OH-) D. ![]()
若该溶液升高温度,上述4种表达式的数据增大的是_________________。
(3)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH 变化如图所示,则稀释后,醋酸溶液中由水电离出来的c(H+)_______(填“大于”、“等于”或“小于”)HX 溶液中由水电离出来的c(H+)。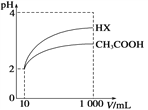
Ⅱ.(1)下列化学方程式可能正确的是______________。
A. ![]() B.
B. ![]()
C. ![]() D.
D. ![]()
(2)写出过量CO2通入Na2S溶液中的离子方程式______________________________________。
(3)将过量的氯气通入到少量的碳酸钠溶液中_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列水溶液一定呈中性的是( )
A. pH=7的溶液 B. c(H+)=1.0×10-7mol·L-1的溶液
C. c(H+)=c(OH-)的溶液 D. pH=3的酸与pH=11的碱等体积混合后的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,科学家新合成了一种抗癌、治癌的药物,其化学式可表示为10B20 . 下列叙述正确的是( )
A.10B20为硼元素的一种原子
B.10B20为硼元素的一种单质
C.10B20的中子数比核外电子数多
D.10B20的原子核外电子排布为 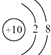
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W,X,Y,Z均为短周期元素,W的最外层电子数与核外电子总数之比为7:17;X与W同主族;Y的原子序数是W和X的原子序数之和的一半;含Z元素的物质焰色反应为黄色.下列判断正确的是( )
A.金属性:Y>Z
B.氢化物的沸点:X>W
C.离子的还原性:X>W
D.原子及离子半径:Z>Y>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有50mLNaOH溶液,向其中逐渐通入一定量的CO2,随后取此溶液10mL将其稀释到100mL,并向此稀释后的溶液中逐滴加入0.1mol/L的HCl溶液,产生的CO2气体体积(标准状况下)与所加入的HCl的体积之间的关系如图所示:试分析:
(1)NaOH在吸收CO2气体后,在甲、乙 两种情况下,所得溶液中存在的溶质是

甲:_____________其物质的量之比是:__________
乙:_____________其物质的量之比是:__________
(2)在两种情况下产生的CO2气体(标准状况)各是甲:___________;乙:___________。
(3)原NaOH溶液的物质的量浓度是___________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com