
【题目】随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。

根据判断出的元素回答问题:
(1)X的原子结构示意图为 ______________。
(2)比较d、e常见离子的半径大小(用化学式表示,下同):______> ;比较g、h的最高价氧化物对应水化物的酸性强弱: >_______。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式:_____________。
【答案】 ![]() r(O2-) > r(Na+) HClO4 > H2SO4
r(O2-) > r(Na+) HClO4 > H2SO4 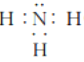 (或
(或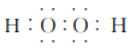 或
或![]() )
)
【解析】8种元素为短周期元素,在同一周期中,从左向右原子半径逐渐变小,同一主族,从上到下原子半径逐渐变小,主族元素最高正化合价一般等于族序数,最低负价=8-主族族序数,从图中的化合价、原子半径的大小及原子序数,可知x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素;根据以上分析解答。
(1)X是H元素,核电荷数为1, 原子结构示意图为 ![]() ;正确答案:
;正确答案:![]() 。
。
(2)电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:r(O2-)>r(Na+);非金属性越强,最高价氧化物水化物的酸性越强,故酸性:HClO4>H2SO4;正确答案:r(O2-) > r(Na+) ; HClO4 > H2SO4 。
(3)四原子共价化合物,可以是NH3、H2O2、C2H2等,其电子式为: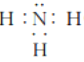 (或
(或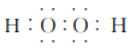
![]() 等);正确答案:
等);正确答案: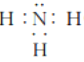 (或
(或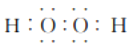 或
或![]() )。
)。


科目:高中化学 来源: 题型:
【题目】四个课外活动小组为完成实验目的,均设计了两套实验装置(部分图中的夹持装置略去),其中一个活动小组设计的两套装置中,有一套装置存在原理错误,该活动小组是
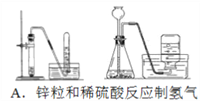
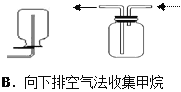
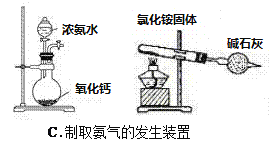
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置应用于实验室进行相关实验,能达到实验目的是( ) 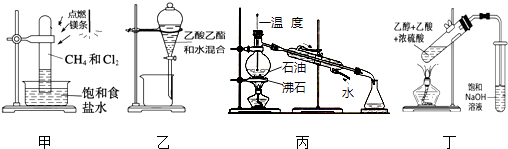
A.用装置甲在强光照条件下制取一氯甲烷
B.用装置乙分离乙酸乙酯和水
C.用装置丙蒸馏石油并收集60~150℃馏分
D.用装置丁制取并收集乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PASNa(二水合对氨基水杨酸钠)是抗结核药,其结构简式如图化合物1所示,下列说法正确的是( ) 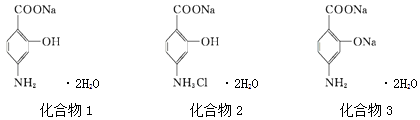
A.化合物1和化合物2均能使酸性KMnO4溶液褪色
B.化合物1的核磁共振氢谱测出5个谱峰
C.PASNa与足量盐酸反应生成如上图化合物2
D.通入足量CO2能将图化合物3转化为PASNa
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X是中学化学常见的物质,A、B、C均由短周期元素组成,转化关系如图。
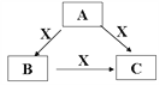
请针对以下三种不同情况回答:
(1)若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,向C的水溶液中通入过量的CO2可得B的白色胶状沉淀。
①A中含有的金属元素为_________(写元素名称),它在周期表中的位置为_____________。
②写出B → C反应的离子方程式为___________________________________。
(2)若A为稀HNO3,X为常见黑色金属单质,写出A→B反应的离子方程式__________。
(3)若A、B、C三种化合物的焰色反应均呈黄色,水溶液均为碱性;将C加到盐酸中,有无色无味的气体X产生。
①A中所含有的化学键是________________
②自然界中存在B、C和H2O按一定比例结晶而成的固体,取一定量该固体溶于水配成一定物质的量浓度的溶液100mL,所用到的玻璃仪器有玻璃棒、烧杯、________、_________。
③若测得上述溶液中金属阳离子的浓度为0.5mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为 ____________ g 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用工业冶炼硫酸铜(含有Fe2+、AsO2-、Ca2+等杂质)提纯制备电镀硫酸铜的生产流程如下:

已知:①Fe3+、Cu2+开始沉淀的pH分别2.7、5.4,完全沉淀的pH分别为3.7、6.4。
②Ksp[Cu(OH)2]=2×10-20
③AsO2-+H2O2+H+=H3AsO4, H3AsO4+Fe3+=FeAsO4↓+3H+
(1)溶解操作中需要配制含铜32 g·L-1的硫酸铜溶液1.0 L,需要称量冶炼级硫酸铜的质量至少为___________g。
(2)测定溶解液中的Fe2+的浓度,可用KMnO4标准溶液滴定,取用KMnO4溶液应使用
________(“酸式”或“碱式”)滴定管,其中反应离子方程式为:______________________。若要检验调节pH后溶液中的Fe3+已除尽的方法是___________________________。
(3)氧化后需要将溶液进行稀释及调节溶液的pH=5,则稀释后的溶液中铜离子浓度最大不能超过____________mol·L-1。
(4)固体Ⅰ的主要成分除 FeAsO4 、Fe(OH)3外还有__________________,由溶液Ⅰ获得CuSO4·H2O,需要经过________ 、____________、过滤、洗涤、干燥操作。
(5)利用以上电镀级硫酸铜作为电解质溶液,电解粗铜(含锌、银、铂杂质)制备纯铜,写出阳极发生的电极反应式:________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com