
【题目】利用工业冶炼硫酸铜(含有Fe2+、AsO2-、Ca2+等杂质)提纯制备电镀硫酸铜的生产流程如下:

已知:①Fe3+、Cu2+开始沉淀的pH分别2.7、5.4,完全沉淀的pH分别为3.7、6.4。
②Ksp[Cu(OH)2]=2×10-20
③AsO2-+H2O2+H+=H3AsO4, H3AsO4+Fe3+=FeAsO4↓+3H+
(1)溶解操作中需要配制含铜32 g·L-1的硫酸铜溶液1.0 L,需要称量冶炼级硫酸铜的质量至少为___________g。
(2)测定溶解液中的Fe2+的浓度,可用KMnO4标准溶液滴定,取用KMnO4溶液应使用
________(“酸式”或“碱式”)滴定管,其中反应离子方程式为:______________________。若要检验调节pH后溶液中的Fe3+已除尽的方法是___________________________。
(3)氧化后需要将溶液进行稀释及调节溶液的pH=5,则稀释后的溶液中铜离子浓度最大不能超过____________mol·L-1。
(4)固体Ⅰ的主要成分除 FeAsO4 、Fe(OH)3外还有__________________,由溶液Ⅰ获得CuSO4·H2O,需要经过________ 、____________、过滤、洗涤、干燥操作。
(5)利用以上电镀级硫酸铜作为电解质溶液,电解粗铜(含锌、银、铂杂质)制备纯铜,写出阳极发生的电极反应式:________________。
【答案】 80 酸式 MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O 取少量溶液Ⅰ于试管中, 滴加几滴KSCN溶液,若溶液不出现红色,则说明Fe3+已经除尽 2×10-2 CaCO3 蒸发浓缩 冷却结晶 Zn-2e-= Zn2+、Cu-2e-=Cu2+
【解析】(1)溶解操作中需要配制含铜32g·L-1的硫酸铜溶液1.0L,需要称量冶炼级硫酸铜的质量至少为m(CuSO4)=![]() =80g;(2)高锰酸钾具有强氧化性,会腐蚀碱式滴定管的橡皮管,取用KMnO4溶液应使用酸式滴定管;MnO4-将Fe2+氧化为Fe3+,同时MnO4-被还原为Mn2+,发生反应的离子方程式为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;若要检验调节pH后溶液中的Fe3+已除尽的方法是取少量溶液Ⅰ于试管中,滴加几滴KSCN溶液,若溶液不出现红色,则说明Fe3+已经除尽;(3)溶液pH=5,c(OH-)=10-9mol/L,则稀释后的溶液中铜离子浓度最大不能超过
=80g;(2)高锰酸钾具有强氧化性,会腐蚀碱式滴定管的橡皮管,取用KMnO4溶液应使用酸式滴定管;MnO4-将Fe2+氧化为Fe3+,同时MnO4-被还原为Mn2+,发生反应的离子方程式为:MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O;若要检验调节pH后溶液中的Fe3+已除尽的方法是取少量溶液Ⅰ于试管中,滴加几滴KSCN溶液,若溶液不出现红色,则说明Fe3+已经除尽;(3)溶液pH=5,c(OH-)=10-9mol/L,则稀释后的溶液中铜离子浓度最大不能超过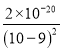 mol/L=2×10-2 mol/L;(4)由以上分析可知固体I的主要成分除 FeAsO4、Fe(OH)3外还有CaCO3,操作I从溶液中获得晶体,可蒸发浓缩、冷却结晶、过滤、洗涤、干燥;(5)电解粗铜(含锌、银、铂杂质)制备纯铜,阳极发生氧化反应,阳极发生的电极反应方程式为Zn-2e-=Zn2+、Cu-2e-=Cu2+。
mol/L=2×10-2 mol/L;(4)由以上分析可知固体I的主要成分除 FeAsO4、Fe(OH)3外还有CaCO3,操作I从溶液中获得晶体,可蒸发浓缩、冷却结晶、过滤、洗涤、干燥;(5)电解粗铜(含锌、银、铂杂质)制备纯铜,阳极发生氧化反应,阳极发生的电极反应方程式为Zn-2e-=Zn2+、Cu-2e-=Cu2+。


科目:高中化学 来源: 题型:
【题目】随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。

根据判断出的元素回答问题:
(1)X的原子结构示意图为 ______________。
(2)比较d、e常见离子的半径大小(用化学式表示,下同):______> ;比较g、h的最高价氧化物对应水化物的酸性强弱: >_______。
(3)任选上述元素组成一种四原子共价化合物,写出其电子式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将从大肠杆菌细胞中提取到的核酸彻底进行水解,直至形成不能再水解的小分子,则能得到的小分子的种类共有
A. 9种 B. 8种 C. 6种 D. 4种
查看答案和解析>>
科目:高中化学 来源: 题型:
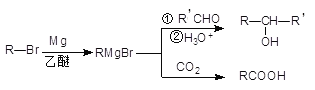
【题目】格林尼亚试剂简称“格氏试剂”,是有机卤化物与金属镁在无水乙醚或四氢呋喃(THF)中反应制得,在有机合成中用途广泛。反应原理如下:
由A( ![]() )合成 I (
)合成 I ( ![]() )的流程图:
)的流程图:
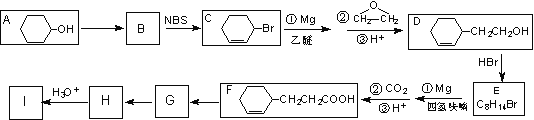
(已知:NBS为溴化试剂,在一定条件下能与烯烃作用生成溴代烯烃。)
(1) 物质A的名称为_________________;由A生成B的反应类型是_________;
(2) 写出由A制备 ![]() 的化学方程式_________________________;
的化学方程式_________________________;
(3) 四氢呋喃是一种优良的溶剂,可由呋喃( ![]() )加氢得到,则四氢呋喃的结构简式为_____________________;
)加氢得到,则四氢呋喃的结构简式为_____________________;
(4) 写出由G生成H的化学方程式_____________________________________;
(5) 写出符合下列要求的I的同分异构体的结构简式_____________________;(写出一种即可,同一碳上不能连接2个羟基)
① 芳香族化合物 ② 二元醇 ③ 分子中有5种化学环境的H
(6) 参照上述信息,以A和A制得的环己酮( ![]() )为原料合成
)为原料合成![]() (
(![]() )______________________。
)______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应:2SO2(g)+O2(g)2SO3(g)(正反应放热),如图是某次实验的化学反应速率随时间变化的图象,推断在t1时刻突然变化的条件可能是( ) 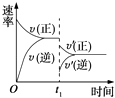
A.催化剂失效
B.减小生成物的浓度
C.降低体系温度
D.增大容器的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酒精灯加热下列溶液,蒸干后灼烧,所得固体质量最大的是( )
A.20 mL 2 mol/L FeCl3溶液
B.40 mL 1 mol/L NaHCO3溶液
C.20 mL 1 mol/L Na2SO3溶液
D.40 mL 2 mol/L NH4HCO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,浓度均为1.0molL﹣1的NH3H2O和NH4Cl混合溶液10mL,测得其pH为9.3.下列有关叙述正确的是( )
A.加入适量的NaCl,可使c(NH4+)=c(Cl﹣)
B.滴加几滴浓氨水,c(NH4+)减小
C.滴加几滴浓盐酸, ![]() 的值减小
的值减小
D.1.0 molL﹣1的NH4Cl溶液中c(NH4+)比该混合溶液大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示在密闭容器中反应:2SO2+O22SO3+Q达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是;b c过程中改变的条件可能是; 若增大压强时,反应速度变化情况画在c~d处. 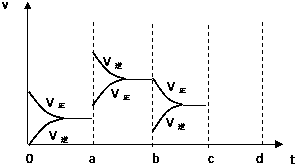
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组查阅资料得知,漂白粉与硫酸溶液反应可制取氯气,化学方程式为:Ca(ClO)2+CaCl2+2H2SO4![]() 2CaSO4+2Cl2↑+2H2O,他们设计如下实验制取氯气并验证其性质。请回答下列问题:
2CaSO4+2Cl2↑+2H2O,他们设计如下实验制取氯气并验证其性质。请回答下列问题:
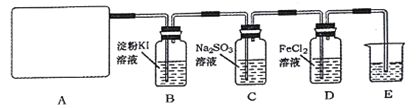
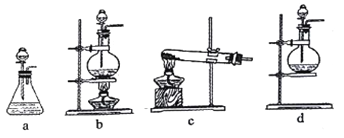
(1)该实验中A部分的装置是___ (填写装置的序号)。
(2)装置B中的现象是_________。
(3)请写出装置D中反应的离子方程式_________,装置E的作用是_______。
(4)请帮助他们设计一个实验,证明洗气瓶C中的亚硫酸钠已被氧化(简述实验步骤):______。
(5)制取Cl2的方法有多种,请再写出一种制备方法,____________(用化学方程式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com