
【题目】将从大肠杆菌细胞中提取到的核酸彻底进行水解,直至形成不能再水解的小分子,则能得到的小分子的种类共有
A. 9种 B. 8种 C. 6种 D. 4种
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】四个课外活动小组为完成实验目的,均设计了两套实验装置(部分图中的夹持装置略去),其中一个活动小组设计的两套装置中,有一套装置存在原理错误,该活动小组是
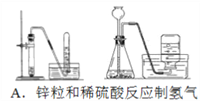
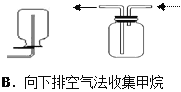
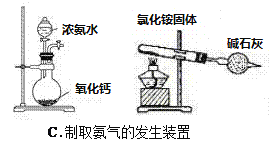
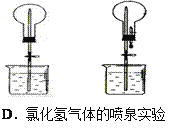
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X是中学化学常见的物质,A、B、C均由短周期元素组成,转化关系如图。
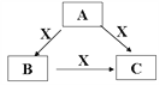
请针对以下三种不同情况回答:
(1)若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形式存在,向C的水溶液中通入过量的CO2可得B的白色胶状沉淀。
①A中含有的金属元素为_________(写元素名称),它在周期表中的位置为_____________。
②写出B → C反应的离子方程式为___________________________________。
(2)若A为稀HNO3,X为常见黑色金属单质,写出A→B反应的离子方程式__________。
(3)若A、B、C三种化合物的焰色反应均呈黄色,水溶液均为碱性;将C加到盐酸中,有无色无味的气体X产生。
①A中所含有的化学键是________________
②自然界中存在B、C和H2O按一定比例结晶而成的固体,取一定量该固体溶于水配成一定物质的量浓度的溶液100mL,所用到的玻璃仪器有玻璃棒、烧杯、________、_________。
③若测得上述溶液中金属阳离子的浓度为0.5mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为 ____________ g 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列几项中,在生物体内含量较少,但是对于维持生物体的正常生命活动必不可少的元素是
A. Fe、Mn、Zn、Mg B. Cu、Zn、Mn、K
C. Mn、Zn、B、Cu D. Cu、N、S、Mo
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若aAm+与bBn-的核外电子排布相同,则下列关系不正确的是
A. b=a-n-mB. 离子半径Am+<Bn-
C. 原子半径A<BD. A的原子序数比B大(m+n)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用工业冶炼硫酸铜(含有Fe2+、AsO2-、Ca2+等杂质)提纯制备电镀硫酸铜的生产流程如下:

已知:①Fe3+、Cu2+开始沉淀的pH分别2.7、5.4,完全沉淀的pH分别为3.7、6.4。
②Ksp[Cu(OH)2]=2×10-20
③AsO2-+H2O2+H+=H3AsO4, H3AsO4+Fe3+=FeAsO4↓+3H+
(1)溶解操作中需要配制含铜32 g·L-1的硫酸铜溶液1.0 L,需要称量冶炼级硫酸铜的质量至少为___________g。
(2)测定溶解液中的Fe2+的浓度,可用KMnO4标准溶液滴定,取用KMnO4溶液应使用
________(“酸式”或“碱式”)滴定管,其中反应离子方程式为:______________________。若要检验调节pH后溶液中的Fe3+已除尽的方法是___________________________。
(3)氧化后需要将溶液进行稀释及调节溶液的pH=5,则稀释后的溶液中铜离子浓度最大不能超过____________mol·L-1。
(4)固体Ⅰ的主要成分除 FeAsO4 、Fe(OH)3外还有__________________,由溶液Ⅰ获得CuSO4·H2O,需要经过________ 、____________、过滤、洗涤、干燥操作。
(5)利用以上电镀级硫酸铜作为电解质溶液,电解粗铜(含锌、银、铂杂质)制备纯铜,写出阳极发生的电极反应式:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁及其化合物在生产、生活中应用广泛。
Ⅰ.(1)镁在元素周期表中的位置为___________
(2)镁的碳化物常见的有MgC2和Mg2C3两种,可分别发生水解反应生成乙炔和丙二烯,写出MgC2水解反应的方程式为_________;Mg2C3的电子式为_________.
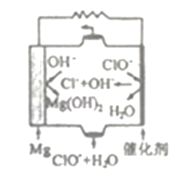
(3)由Mg可制成“镁一次氯酸盐”燃料电池,其装置示意图如下图所示,该电池反应的离子方程式为____________.
Ⅱ.利用氯碱工业盐泥[含Mg(OH)2及少量的CaCO3、MnCO3、FeCO3、Al(OH)3、SiO2等]生产MgSO4·7H2O的工艺流程如下图所示。
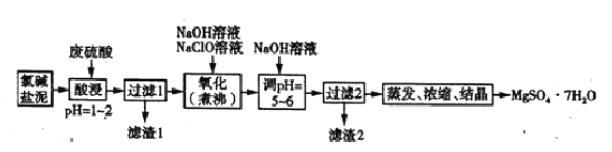
(4)酸浸时,FeCO3与硫酸反应的化学方程式为_____________,为了提高浸取率可采取的措施有_____(填字母)。
a.多次用废硫酸浸取 b.减小盐泥粒度并充分搅拌 c.适当延长浸取时间
(5)氧化时,次氯酸钠溶液将MnSO4氧化为MnO2的离子程式为______________;滤渣2为MnO2和_____________、___________(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com