
【题目】法国一家公司研发出一种比锂电池成本更低、寿命更长、充电速度更快的钠离子电池,该电池的负极材料为Na2Co2TeO6(制备原料为Na2CO3、Co3O4和TeO2),电解液为NaClO4的碳酸丙烯酯溶液。回答下列问题:
(1)C、O、Cl三种元素电负性由大到小的顺序为________________________。
(2)基态Na原子中,核外电子占据的原子轨道总数为______,Te属于元素周期表中______区元素,其基态原子的价电子排布式为______________________。
(3)CO32-的空间构型为___________________,碳酸丙烯酯的结构简式如图所示,
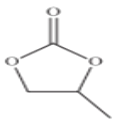
其中碳原子的杂化轨道类型为____________,1mol碳酸丙烯酯中σ键的数目为_________________。
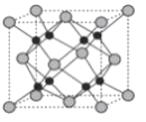
(4)Na和O形成的离子化合物的晶胞结构如图所示,晶胞中O的配位数为____________,该晶胞的密度为ρg/cm3,阿伏加德罗常数的值为NA,则Na与O之间的最短距离为____________cm(用含有ρ、NA的代数式表示)。
【答案】O>Cl>C (或OClC) 6 p 5s25p4 平面三角形 sp2、sp3 13NA(或13×6.02×1023) 8 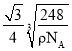
【解析】
(1)元素的非金属性越强其电负性越大,O、Cl、C的非金属性大小顺序是O>Cl>C,所以其电负性大小顺序是O>Cl>C;
(2)Na元素的原子序数为11,基态原子的电子排布式为:1s22s22p63s1,每个能级字母前的数字表示电子层数,所以该元素含有3个电子层,各能级包含的原子轨道数按s、p、d、f的顺序依次为1、3、5、7,该元素含有s、p能级,1+1+3+1=6个轨道;Te原子为52号元素,位于周期表第五周期、第VIA族,价电子排布式为5s25p4,属于p区;
(3)CO32-中碳原子价层电子对个数=3+![]() (4+2-3×2)=3,且不含孤电子对,所以C原子采用sp2杂化,空间构型为平面三角形;碳酸丙烯酯中碳原子为单键和双键,单键形成4个σ键,没有孤对电子,杂化轨道数目为4,为sp3杂化,双键形成3个σ键,没有孤对电子,杂化轨道数目为3,sp2杂化,所以碳原子的杂化轨道类型为sp2、sp3,σ键的总数目为13,即13NA(或13×6.02×1023);
(4+2-3×2)=3,且不含孤电子对,所以C原子采用sp2杂化,空间构型为平面三角形;碳酸丙烯酯中碳原子为单键和双键,单键形成4个σ键,没有孤对电子,杂化轨道数目为4,为sp3杂化,双键形成3个σ键,没有孤对电子,杂化轨道数目为3,sp2杂化,所以碳原子的杂化轨道类型为sp2、sp3,σ键的总数目为13,即13NA(或13×6.02×1023);
(4)氧离子半径大于钠离子半径,所以白色球为O,晶胞中白色球数目为8×![]() +6×
+6×![]() =4,黑色球为Na,共8个,由晶胞对称性可知O的配位数为8;根据晶胞结构可知Na周围距离最近的4个O形成正四面体,顶点O与正四面体体心的Na连线处于晶胞体对角线上,Na与O之间的最短距离为体对角线的
=4,黑色球为Na,共8个,由晶胞对称性可知O的配位数为8;根据晶胞结构可知Na周围距离最近的4个O形成正四面体,顶点O与正四面体体心的Na连线处于晶胞体对角线上,Na与O之间的最短距离为体对角线的![]() ,晶胞体积=
,晶胞体积=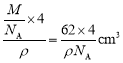 ,晶胞边长=
,晶胞边长=![]() cm,则Na与O之间的最短距离为
cm,则Na与O之间的最短距离为![]() cm。
cm。


科目:高中化学 来源: 题型:
【题目】用如图所示装置检验对应气体时,不能达到目的是
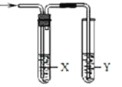
(X—除杂装置、Y—检验装置)
实验目的 | 试剂X | 试剂Y | |
A | 检验溴蒸汽中混有的NO2 | CCl4试剂 | 石蕊试液 |
B | 检验HI中混有的HCl | 饱和NaCl溶液 | AgNO3溶液 |
C C | 浓盐酸与MnO2共热制取的氯气 | NaOH溶液 | 淀粉KI溶液 |
D | C2H5OH与浓H2SO4加热至170℃制取的乙烯 | NaOH溶液 | Br2的CCl4溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醛能够发生下列反应:
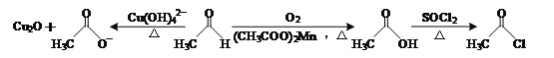
(1)Mn2+的基态电子排布式为____。
(2)氯化亚砜(SOCl2)是有机合成中重要的氯化剂,与SOCl2互为等电子体的阴离子的化学式为____。
(3)CH3CHO分子中碳原子的轨道杂化类型是____。
(4)乙酸的沸点(117.9 ℃)比乙醛的沸点(20.8 ℃)高的主要原因是____。
(5)不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为____。
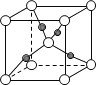
(6)如图表示Cu2O的晶胞,Cu+的配位数是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种短周期主族元素,它们的原子序数依次增大,其中A元素原子核外电子仅有一种原子轨道,也是宇宙中最丰富的元素,B元素原子核外p电子数比s电子数少1,C为金属元素且原子核外p电子数和s电子数相等,D元素的原子核外所有p轨道全充满或半充满。
(1)写出四种元素的元素符号:
A________,B________,C________,D________。
(2)写出C、D两种元素基态原子核外电子轨道表示式。
C_______________________________________________________________,
D_______________________________________________________________。
(3)写出B、C两种元素单质在一定条件下反应的化学方程式____________________________________________。
(4)写出B元素单质和氢化物的电子式:单质________,氢化物__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲池的总反应式为:N2H4+O2=N2+H2O,下列关于该电池工作时的说法正确的是( )

A. 该装置工作时,Ag电极上有气体生成
B. 甲池中负极反应为N2H4-4e-=N2+4H+
C. 甲池和乙池中的溶液的pH均减小
D. 当甲池中消耗0.1molN2H4时,乙池中理论上最多产生6.4g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锆(![]() )是现代工业的重要金属原料,具有良好的可塑性,抗蚀性能超过钛。以锆英石(主要成分是
)是现代工业的重要金属原料,具有良好的可塑性,抗蚀性能超过钛。以锆英石(主要成分是![]() ,还含有少量
,还含有少量![]() 等杂质)为原料生产锆及其化合物的流程如图所示
等杂质)为原料生产锆及其化合物的流程如图所示
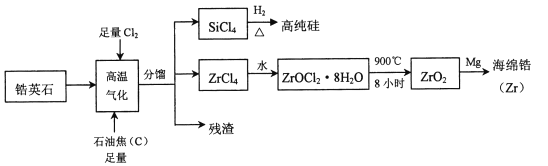
(1)写出![]() 的电子式____________________。
的电子式____________________。
(2)高温气化过程中,不考虑损失,发现分馏后得到的![]() 质量通常比由纯
质量通常比由纯![]() 发生的反应得到的
发生的反应得到的![]() 质量大,用化学方程式来解释原因_________________________。
质量大,用化学方程式来解释原因_________________________。
(3)高温气化后的固体残渣除碳外,还有![]() 和
和![]() ,加水浸取得氯化铁溶液,过滤,从滤渣中分离出碳和
,加水浸取得氯化铁溶液,过滤,从滤渣中分离出碳和![]() 两种固体的方法是____________________。
两种固体的方法是____________________。
(4)写出上述流程中![]() 与水反应的化学方程式:____________________________。
与水反应的化学方程式:____________________________。
(5)已知氧化锆(![]() )是一种两性氧化物,与氢氧化钠共熔融可形成酸盐,请写出化学方程式_________________________________________。
)是一种两性氧化物,与氢氧化钠共熔融可形成酸盐,请写出化学方程式_________________________________________。
(6)工业上可用钾还原![]() 时制得金属
时制得金属![]() ,
,![]() 被还原时生成的钾盐的物质的量为_________________。
被还原时生成的钾盐的物质的量为_________________。
(7)已知![]() ,
,![]() 。下列说法正确的是__________
。下列说法正确的是__________
A.![]() ,电解质溶液的
,电解质溶液的![]() 与
与![]() 之和均为14
之和均为14
B.用盐酸滴定某浓度的![]() 溶液,滴定过程中
溶液,滴定过程中![]() 逐渐增大
逐渐增大
C.![]() 溶液中逐滴加入硫酸溶液,滴加过程中
溶液中逐滴加入硫酸溶液,滴加过程中![]() 逐渐减小
逐渐减小
D.某温度下![]() ,则其溶液中
,则其溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】直接排放含SO2的烟气会形成酸雨,危害环境。工业上常采用催化还原法和碱吸收法处理SO2气体。
(1)如图所示:1molCH4完全燃烧生成气态水的能量变化和1molS(g)燃烧的能量变化。
在催化剂作用下,CH4可以还原SO2生成单质S(g)、H2O(g)和CO2,写出该反应的热化学方程式___。
(2)焦炭催化还原二氧化硫的化学方程式为2C(s)+2SO2(g)![]() S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率和S2(g)的生成速率随温度变化的关系如图所示:
S2(g)+2CO2(g)。一定压强下,向1L密闭容器中充入足量的焦炭和1molSO2发生反应,测得SO2的生成速率和S2(g)的生成速率随温度变化的关系如图所示:

①A、B、C、D四点对应的状态中,达到平衡状态的有___(填字母)。
②该反应的ΔH___0(填“>”“<”或“=”)
③下列措施能够增大SO2平衡转化率的是___。
A.降低温度 B.增加C的量 C.减小容器体积 D.添加高效催化剂
(3)用氨水吸收SO2。25℃时2.0mol·L-1的氨水中,NH3·H2O的电离度α=___(α=![]() ×100%)。。将含SO2的烟气通入该氨水中,当溶液显中性时,溶液中的
×100%)。。将含SO2的烟气通入该氨水中,当溶液显中性时,溶液中的![]() =___。(已知25℃,Kb(NH3·H2O)=1.8×10-5;Ka1(H2SO3)=1.3×10-2,Ka2(H2SO3)=6.2×10-8)
=___。(已知25℃,Kb(NH3·H2O)=1.8×10-5;Ka1(H2SO3)=1.3×10-2,Ka2(H2SO3)=6.2×10-8)
(4)当吸收液失去吸收能力后通入O2可得到NH4HSO4溶液,用如图所示装置电解所得NH4HSO4溶液可制得强氧化剂(NH4)2S2O8。
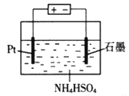
写出电解NH4HSO4溶液的化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸铁锂电池在充放电过程中表现出了良好的循环稳定性,具有较长的循环寿命,放电时的反应为:LixC6+Li1-xFePO4=6C+LiFePO4 。某磷酸铁锂电池的切面如下图所示。下列说法错误的是

A.放电时Li+脱离石墨,经电解质嵌入正极
B.隔膜在反应过程中只允许Li+ 通过
C.充电时电池正极上发生的反应为:LiFePO4-xe-= Li1-xFePO4+xLi+
D.充电时电子从电源经铝箔流入正极材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2﹣羟基异丁酸乙酯能溶于水,是一种应用于有机合成和药物制造的化工原料。

(1)2﹣羟基异丁酸乙酯的分子式为_________,不同化学环境的氢在核磁共振氢谱图中有不同的吸收峰,则2﹣羟基异丁酸乙酯有_________个吸收峰;
(2)①②的反应类型分别为_________,_________;
(3)已知I为溴代烃,I→B的化学方程式为_________;
(4)缩聚产物F的结构简式为_________;
(5)下列关于![]() 和
和 的说法正确的有_________(双选,填字母);
的说法正确的有_________(双选,填字母);
A.后者遇到FeCl3溶液显紫色,而前者不可
B.两者都可以与NaHCO3溶液反应放出CO2
C.两者都可以与氢氧化钠溶液发生反应,当两者物质的量相等时,消耗氢氧化钠的量不相等
D.两者都可以与氢气发生加成反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com