
【题目】焦亚硫酸钠(Na2S2O5)有广泛的用途,实验室中通过如下方法制备:
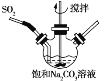
①不断搅拌条件下,在饱和Na2CO3溶液中缓缓通入SO2至反应完全;
②取下三颈烧瓶,测得反应液的pH=4.1;
③将溶液蒸发浓缩、结晶、过滤得焦亚硫酸钠晶体。
请回答下列问题:
(1)实验室可利用Na2SO3和较浓的硫酸制备少量SO2气体,该反应的化学方程式为_______________。硫酸浓度太大不利于SO2气体逸出,原因是_____________。制备、收集干燥的SO2气体时,所需仪器如下。装置A是气体发生装置,按气流方向连接各仪器口,顺序为a→____→____→____→____→f。装置D的作用是__________。

(2)步骤①反应的离子方程式为________________,合成Na2S2O5的总化学方程式为__________________。
(3)在强碱性条件下利用Na2S2O5氧化HCOONa的方法可制备保险粉连二亚硫酸钠(Na2S2O4),反应的离子方程式为___________。
(4)工业上用焦亚硫酸钠法制备保险粉带来的主要问题是废水中含有大量的有机物,有机物总含碳量用TOC表征,常采用Fenton 氧化法去除废水中的有机物,即通过向废水中加入H2O2,以Fe2+作催化剂,产生具有强氧化性的羟基自由基(·OH)来氧化降解废水中的有机物。
①其他条件一定时,n(H2O2 )∶n(Fe2+)的值对TOC 去除效果的影响如图1所示:
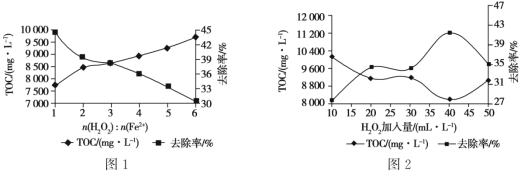
当TOC的去除率最大时,n(H2O2)∶n(Fe2+)=____。
②在pH=4.5,其他条件一定时,H2O2的加入量对TOC 去除效果的影响如图2所示,当H2O2的加入量大于40 mL·L-1时,TOC 去除率反而减小的原因是_______________________________________。
【答案】Na2SO3+H2SO4=Na2SO4+SO2↑+H2O 浓硫酸中只有少量H2SO4电离,c(H+)很小,导致复分解反应速率慢 d e c b 防止倒吸 CO32—+2SO2+H2O=2HSO3—+CO2 Na2CO3+2SO2=Na2S2O5+CO2 HCOO-+S2O52—+OH-= CO32—+ S2O42—+H2O 1 酸性条件下H2O2直接与Fe2+反应,导致溶液中羟基自由基(·OH)浓度减小,使得TOC去除率下降
【解析】
(1) 实验室用Na2SO3和硫酸制备少量SO2气体时,若硫酸浓度太大,则c(H+)较小,导致复分解反应速率慢,若硫酸浓度太小,则由于SO2气体易溶于水,也不利于SO2气体逸出;
收集SO2时,应先干燥,再收集——向上排空气法(长进短出);又因SO2易溶于水,要有防倒吸装置(安全装置);
(2) 反应终止时溶液的pH=4.1,可推测反应的产物是NaHSO3而不是Na2SO3,NaHSO3是弱酸的酸式盐,书写离子方程式时要注意拆分形式;起始原料是SO2和Na2CO3,目标产物是Na2S2O5,根据质量守恒可写出化学方程式;
(3) 书写该氧化还原反应方程式的关键是确定HCOONa的氧化产物,在强碱性条件下,HCOONa中+2价碳必被氧化为CO32—;
(4)①去除率最高时,TOC的含量最低,由图1可得此时n(H2O2)∶n(Fe2+)=1;
②当H2O2的加入量大于40 mL·L-1时,随着H2O2含量增加去除率反而降低,说明H2O2必参加了其他副反应。
(1)①亚硫酸钠和硫酸反应生成二氧化硫、硫酸钠和水,反应的化学方程式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,故答案为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
②若硫酸浓度太大,主要以硫酸分子存在,溶液中c(H+)较小,导致复分解反应速率慢;若硫酸浓度太小,由于SO2气体易溶于水,不利于SO2气体逸出,故答案为浓硫酸中只有少量H2SO4电离,c(H+)很小,导致复分解反应速率慢;
③装置A用以制备二氧化硫气体、装置C用以干燥二氧化硫气体、装置B用向上排空气法收集比空气密度大的二氧化硫气体、装置D和E用以吸收二氧化硫气体,则按气流方向连接各仪器口,顺序为a→d→e→c→b→f;二氧化硫易溶于氢氧化钠溶液,D为安全瓶,可防止倒吸,故答案为d、e、c、b;防止倒吸;
(2)由反应终止时溶液的pH=4.1可知,步骤①为向Na2CO3过饱和溶液中通入SO2,发生反应生成NaHSO3和CO2,反应的离子方程式为2SO2+CO32-+H2O=2HSO3-+CO2,合成Na2S2O5的总反应为Na2CO3和SO2反应生成Na2S2O5和CO2反应的化学方程式为Na2CO3+2SO2═Na2S2O5+CO2,故答案为2SO2+CO32-+H2O=2HSO3-+CO2;Na2CO3+2SO2═Na2S2O5+CO2;
(3)由题给信息可知,Na2S2O5氧化HCOONa的方法可制备Na2S2O4时,S元素化合价由+4价降低为+3价,则在强碱性条件下,HCOONa中+2价碳必被氧化为CO32—,反应的离子方程式为:HCOO-+S2O52—+OH-= CO32—+ S2O42—+H2O,故答案为HCOO-+S2O52—+OH-= CO32—+ S2O42—+H2O;
(4)①去除率最高时,TOC的含量最低,由图1可得此时n(H2O2)∶n(Fe2+)=1,故答案为1;
②当H2O2的加入量大于40 mL·L-1时,随着H2O2含量增加去除率反而降低,说明酸性条件下H2O2直接与Fe2+反应,导致溶液中羟基自由基(·OH)浓度减小,使得TOC去除率下降,故答案为酸性条件下H2O2直接与Fe2+反应,导致溶液中羟基自由基(·OH)浓度减小,使得TOC去除率下降。


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】最近科学家获得了一种稳定性好、抗氧化能力强的活性化合物A;其结构如下:

为了研究X的结构,将化合物A在一定条件下水解只得到 和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
请回答下列问题:
(1)化合物B能发生下列哪些类型的反应________。
A.取代反应 B.加成反应
C.缩聚反应 D.氧化反应
(2)写出化合物C所有可能的结构简式______________________________。
(3)C可通过下图所示途径合成,并制取冬青油和阿司匹林。

(ⅰ)写出有机物的结构简式:D:______________,C:________________,E:______________。
(ⅱ)写出变化过程中①、⑥的化学方程式(注明反应条件)
反应①__________________________________;反应⑥_____________________________。
(ⅲ)变化过程中的②属于____________反应,⑦属于________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中有关微粒的物质的量浓度关系正确的是( )
A.等物质的量浓度等体积的NH4HSO4和NaOH溶液混合:c(Na+)=c(SO42-)>c(NH4+)>c(OH-)>c(H+)
B.常温下,将CH3COONa溶液和稀盐酸混合至溶液pH=7:c(Na+)>(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)=c(OH-)
C.常温下,pH=6的NaHSO3溶液中:c(SO32-)﹣c(H2SO3)=9.9×10-7molL-1
D.物质的量浓度之比为1:2的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=2c(HCO3-)+2c(H2CO3)+2c(CO32-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 烷烃的通式为CnH2n+2,随n值增大,碳元素的质量百分含量逐渐减小
B. 乙烯与溴加成反应的产物为溴乙烷
C. 1 mol苯恰好与3 mol氢气完全加成,说明苯分子中有三个碳碳双键
D. 当n=7,主链上有5个碳原子的烷烃共有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌银电池的负极为锌,正极为氧化银,电解质是KOH,电池反应为Zn+Ag2O+H2O![]() Zn(OH)2+2Ag。以锌银电池为电源,电解硫酸镍溶液冶炼纯镍,装置如图所示。
Zn(OH)2+2Ag。以锌银电池为电源,电解硫酸镍溶液冶炼纯镍,装置如图所示。

下列说法正确的是
A.装置中使用阳离子交换膜
B.锌银电池a极反应式为Ag2O+H2O+2e-![]() 2Ag+2OH-
2Ag+2OH-
C.镍极的主要反应为2H++2e-![]() H2↑
H2↑
D.若锌银电池溶解13 g锌,则镍极净增质量最多为5.9 g
查看答案和解析>>
科目:高中化学 来源: 题型:
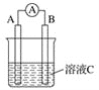
【题目】(1)如图所示,若C为浓硝酸,电流表指针发生偏转,B电极材料为Fe ,A电极材料为Cu,则B电极的电极反应式为___________,A电极的电极反应式为_______;反应进行一段时间后溶液C的pH将___ (填“升高”“降低”或“基本不变”)。
(2)我国首创以铝空气海水电池作为能源的新型的海水标志灯,以海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水数分钟,就会发出耀眼的白光。则电源的负极材料是____,负极反应为___________;正极反应为_____________________________。
(3)熔盐电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650 ℃下工作的燃料电池,完成有关电池反应式。负极反应式为2CO+2CO32--4e-=4CO2,正极反应式为___________,电池总反应式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、恒容下,有下列气体反应分别从两条途径进行:

下列叙述正确的是( )
A. Ⅰ、Ⅱ两条途径最终达到平衡时,体系内混合气体的百分组成相同
B. Ⅰ、Ⅱ两条途径最终达到平衡时,体系内混合气体的浓度相同
C. 达到平衡时,Ⅰ途径所用的时间与Ⅱ途径所用的时间相同
D. 达到平衡时,Ⅰ途径混合气体密度等于Ⅱ途径混合气体的密度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物G是合成维生素类药物的中间体,其结构简式如图1所示,G的合成路线如图2所示:
其中A~F分别代表一种有机化合物,合成路线中部分产物及反应条件已略去
已知:-CHO+
请回答下列问题:
(1)G的分子式是__,G中官能团的名称是__;
(2)第①步反应的化学方程式是__;
(3)B的名称(系统命名)是__;
(4)第②~⑥步反应中属于取代反应的有__(填步骤编号);
(5)第④步反应的化学方程式是________;
(6)写出同时满足下列条件的E的所有同分异构体的结构简式__,①只含一种官能团;②链状结构且无﹣O﹣O﹣;③核磁共振氢谱只有2种峰。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiCoO2用途广泛,如可作为锂离子电池的电极。回答下列问题。
(1)在周期表中,与Li的化学性质最相似的邻族元素是_________,该元素基态原子核外M层电子的自旋状态_________(填“相同”或“相反”)。
(2)[Co(NH3)6]Cl3是橙黄色晶体,该配合物中提供空轨道接受孤对电子的微粒是___,配体分子的价层电子对互斥模型为___,写出一种与配体分子互为等电子体的分子_________(填分子式)。
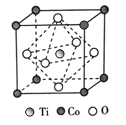
(3)某钴化合物纳米粉可以提高碱性电池的性能。该化合物晶胞结构如图所示,则该钴化合物的化学式为______,与Co原子等距离且最近的O原子个数为______。
(4)Li还可形成多种物质。二异丙基胺基锂( )是有机合成中常用的物质,氮原子的杂化方式为_________。Li+可以镶嵌在C60中,形成的[LiC60]PF6与NaCl具有类似的晶胞结构,下面是从某晶体结构中分割出来的部分结构图,其中属于从[LiC60]PF6晶体中分割出来的结构图是___。
)是有机合成中常用的物质,氮原子的杂化方式为_________。Li+可以镶嵌在C60中,形成的[LiC60]PF6与NaCl具有类似的晶胞结构,下面是从某晶体结构中分割出来的部分结构图,其中属于从[LiC60]PF6晶体中分割出来的结构图是___。
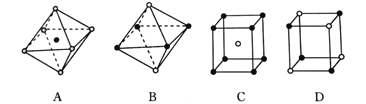
(5)金属锂晶体的结构为体心立方密堆积,晶胞边长为351 pm,则锂晶体中原子的空间利用率为_________(列出含π的计算式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com