
下列说法不正确的是( )
A.溶液中滴加盐酸酸化的BaCl2溶液出现白色沉淀,则溶液中不一定存在SO42-
B.形成酸雨的氧化物主要是SO2和氮的氧化物,CO2是造成温室效应的主要气体
C.氯气泄漏,自救方法是用湿毛巾或蘸有纯碱水的毛巾捂住口鼻并向地势低的地方撤离
D.大气中的N2可转化为NO,NO可转化为NO2、硝酸等;含硫物质在自然界中可转化为SO2等含硫化合物
科目:高中化学 来源: 题型:
进行淀粉水解实验(包括检验水解产物及水解是否完全)除淀粉外,还使用下列试剂或其中的一部分:①碘水②银氨溶液③NaOH溶液④稀硫酸⑤pH试纸.使用上述试剂的顺序依次是
A.①②③④ B.④①③②
C.④①②③ D.④①③②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
电解质溶液为氢氧化钾水溶液的氢氧燃料电池电解饱和碳酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法正确的是( )
A.当电池负极消耗mg气体时,电解池阳极同时有mg气体生成
B.电池负极反应式为:O2 + 2H2O + 4e— = 4OH—
C.电解后c(Na2CO3)不变,且溶液中有晶体析出
D.电池中c(KOH)不变;电解池中溶液pH变大
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.由于氧化性HNO3大于H2SO4,所以非金属性:氮大于硫
B.科学家在金属和非金属交界线处寻找催化剂
C.只有主族元素是由短周期和长周期元素共同构成的
D.长周期主族元素X的阳离子X2+的最外层有2个电子,则它是IVA族元素
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、W为四种短周期主族元素,其中X、Z同族,Y、Z同周期,W是短周期主族元素中原子
半径最大的,X原子最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价代数和为6。下
列说法正确的是( )
A.Y和Z的氧化物的水化物酸性Y大于Z的,所以非金属性Y大于Z
B.原子半径由小到大的顺序为:X< Z < Y
C.Y、Z两种元素气态氢化物中,Z的气态氢化物更稳定
D.X与W形成的两种化合物中,阴、阳离子物质的量之比均为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
25oC时,取浓度均为0.1 mol·L-1的醋酸溶液和氨水溶液各20 mL,分别用0.1 mol·L-1NaOH溶液、0.1 mol·L-1盐酸进行中和滴定,滴定过程中pH随滴加溶液的体积变化关系如图所示。下列说法正确的是
A.曲线I中滴加溶液到10 mL时:
c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
B.曲线I中滴加溶液到25 mL时:
c(NH4+)>c(C1-)>c(H+)>c(OH-)
C.曲线II中滴加溶液在10 mL~25 mL之间存在:
c(NH4+)=c(Cl-)>c(OH-)=c(H+)
D.曲线II中滴加溶液到10mL时:
c(CH3COO-)-c(CH3COOH)=2[c(H+)-c(OH-)]
查看答案和解析>>
科目:高中化学 来源: 题型:
根据环保要求,在处理有氰电镀废水时,剧毒的CN-离子在催化剂TiO2颗粒作用下,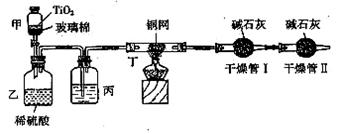 先用NaClO将CN-离子氧化成CNO-(CN-和CNO-中N元素均为-3价),再在酸性条件下继续与NaClO反应生成N2、CO2和Cl2。环保工作人员在密闭系统中用下图装置进行实验,测定
先用NaClO将CN-离子氧化成CNO-(CN-和CNO-中N元素均为-3价),再在酸性条件下继续与NaClO反应生成N2、CO2和Cl2。环保工作人员在密闭系统中用下图装置进行实验,测定
CN-被处理的百分率。
现将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200 mL(其中CN-的浓度为0.2 mol/L)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题:
(1)根据题意,写出相关主要反应的离子方程式:
甲中的反应:
乙中的反应:
(2)上述实验是通过测定CO2的量来确定对CN-的处理效果。
丙装置中的试剂是 ,丁装置的目的是 ;干燥管Ⅱ的作用是 。
(3)假定上述每一个装置都充分吸收,则利用该装置测得的CN-被处理的百分率与实际值相比
__________(填“偏高”或“偏低”),简述可能的原因: 。
(4)若干燥管Ⅰ中碱石灰增重1.408 g,则该实验中测得CN-被处理的百分率为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com