
【题目】把下列四种X溶液分别迅速加入四个盛有10 mL 2 mol·L-1盐酸的烧杯中,此时,X和盐酸立刻进行反应,其中初始反应速率最快的是
A. 10℃ 10 mL 3 mol·L-1的X溶液 B. 20℃ 10 mL 2 mol·L-1的X溶液
C. 20℃ 10 mL 4 mol·L-1的X溶液 D. 10℃ 10 mL 2 mol·L-1的X溶液
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两等份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g(己知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如下图所示。下列分析或结果错误的是
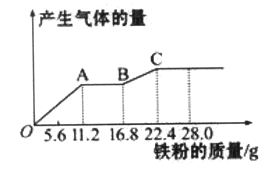
A. OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气
B. 原混合酸中NO3-物质的量为0.4 mol
C. 第二份溶液中最终溶质为FeSO4
D. 取20 mL原混合酸加水稀释至1 L后溶液c(H+) =0.1mol L-l
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用工业冶炼硫酸铜(含有Fe2+、AsO2-、Ca2+等杂质)提纯制备电镀硫酸铜的生产流程如下:

已知:①Fe3+、Cu2+开始沉淀的pH分别2.7、5.4,完全沉淀的pH分别为3.7、6.4。
②Ksp[Cu(OH)2]=2×10-20
③AsO2-+H2O2+H+=H3AsO4, H3AsO4+Fe3+=FeAsO4↓+3H+
(1)溶解操作中需要配制含铜32 g·L-1的硫酸铜溶液1.0 L,需要称量冶炼级硫酸铜的质量至少为___________g。
(2)测定溶解液中的Fe2+的浓度,可用KMnO4标准溶液滴定,取用KMnO4溶液应使用
________(“酸式”或“碱式”)滴定管,其中反应离子方程式为:______________________。若要检验调节pH后溶液中的Fe3+已除尽的方法是___________________________。
(3)氧化后需要将溶液进行稀释及调节溶液的pH=5,则稀释后的溶液中铜离子浓度最大不能超过____________mol·L-1。
(4)固体Ⅰ的主要成分除 FeAsO4 、Fe(OH)3外还有__________________,由溶液Ⅰ获得CuSO4·H2O,需要经过________ 、____________、过滤、洗涤、干燥操作。
(5)利用以上电镀级硫酸铜作为电解质溶液,电解粗铜(含锌、银、铂杂质)制备纯铜,写出阳极发生的电极反应式:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Na2CO3、NaHCO3混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是
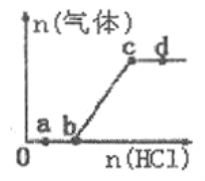
A. a点对应的溶液中:Na+、Ca2+、SO42-、NO3-
B. b点对应的溶液中:K+、Na+、OH-、Cl-
C. c点对应的溶液中: Na+、Ca2+、NO3-、Cl-
D. d点对应的溶液中: Cl-、NO3-、Fe2+、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于化学反应方向的确定不仅与焓变(ΔH)有关,也与温度(T)、熵变(ΔS)有关,实验证明,化学反应的方向应由ΔH-TΔS确定,若ΔH-TΔS<0,则自发进行,否则不能自发进行。下列说法中,正确的是( )
A.在温度、压强一定的条件下,焓因素和熵因素共同决定一个化学反应的方向
B.温度、压强一定时,熵增加的反应一定能自发进行
C.反应焓变是决定反应能否自发进行的唯一因素
D.固体的溶解过程只与焓变有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面的反应路线及所给信息回答问题
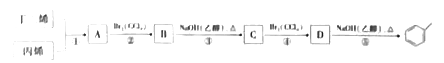
已知:![]()
(1)A中含有的官能团名称是______,A的名称是_____。
(2)不考虑顺反异构,丙烯的二氯代物有____种。
(3)反应类型:①是_________;⑤是_______________。
(4)反应③的化学方程式是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取92g乙醇和60g乙酸反应,如果实际产率是理论产率的67%,则可得到乙酸乙脂的质量近似为是( )
A. 59g B. 88g C. 149.6g D. 176g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素 W、X、Y、Z,原子序数依次增大,请回答下列问题。
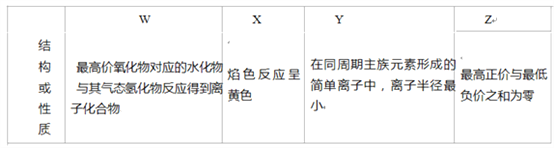
(1)Z 在元素周期表中位于_____族。
(2)上述元素的最高价氧化物对应的水化物中,有一种物质在一定条件下均能与其他三种物质发生化学 反应,该元素是_____(填元素符号).
(3)① 下列可作为比较 X 和 Y 金属性强弱的依据是_____(填序号).
a.自然界中的含量 b.单质与酸反应时失去的电子数
c.单质与水反应的难易程度 d.最高价氧化物对应水化物的碱性
② 从原子结构的角度解释 X 的金属性强于 Y 的原因:_____,原子半径 X>Y,所以原子核 对最外层电子的吸引力 X失电子能力 X>Y.
(4)W 的一种氢化物HW3可用于有机合成,其酸性与醋酸相似。体积和浓度均相等的HW3与 X 的最高 价氧化物对应的水化物混合,反应的化学方程式是_____。
(5)Y 单质和 Mg 组成的混合物是一种焰火原料,某兴趣小组设计如下所示的实验方案,测定混合物中Y的质量分数。

能确定混合物中 Y 的质量分数的数据有_____(填序号).
a. m、n b. m、y c. n、y
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com