
硅是信息产业、太阳能电池光电转化的基础材料。锌还原四氯化硅是一种有着良好应用前景的制备硅的方法,该制备过程示意如下: 
(1)焦炭在过程Ⅰ中作______剂。
(2)过程Ⅱ中的Cl2用电解饱和食盐水制备,制备Cl2的化学方程式是 。
(3)整个制备过程必须严格控制无水。
①SiCl4遇水剧烈水解生成SiO2和一种酸,反应的化学方程式是 。
②干燥Cl2时,从有利于充分干燥和操作安全的角度考虑,需将约90℃的潮湿氯气先冷却至12℃,然后再通入到浓H2SO4中。冷却的作用是 。
(4)Zn还原SiCl4的反应如下:
反应1: 400℃~756℃ ,SiCl4(g) + 2Zn(l)  Si(s) + 2ZnCl2(l) ΔH1 <0
Si(s) + 2ZnCl2(l) ΔH1 <0
反应2: 756℃~907℃ ,SiCl4(g) + 2Zn(l)  Si(s) + 2ZnCl2(g) ΔH2 <0
Si(s) + 2ZnCl2(g) ΔH2 <0
反应3: 907℃~1410℃,SiCl4(g) + 2Zn(g)  Si(s) + 2ZnCl2(g) ΔH3 <0
Si(s) + 2ZnCl2(g) ΔH3 <0
① 对于上述三个反应,下列说法合理的是_____。
a.升高温度会提高SiCl4的转化率 b.还原过程需在无氧的气氛中进行
c.增大压强能提高反应的速率 d.Na、Mg可以代替Zn还原SiCl4
② 实际制备过程选择“反应3”,选择的理由是 。
③ 已知Zn(l)=Zn(g) ΔH =" +116" KJ/mol 。若SiCl4的转化率均为90%,每投入1mol SiCl4,“反应3”比“反应2”多放出_____kJ的热量。
(5)用硅制作太阳能电池时,为减弱光在硅表面的反射,采用化学腐蚀法在其表面形成粗糙的多孔硅层。腐蚀剂常用稀HNO3和HF的混合液。硅表面首先形成SiO2,最后转化为H2SiF6。用化学方程式表示SiO2转化为H2SiF6的过程 。
(1)还原剂(2分)
(2)2NaCl + 2H2O 2NaOH + Cl2↑+ H2↑(2分)
2NaOH + Cl2↑+ H2↑(2分)
(3)① SiCl4 + 2H2O = SiO2 + 4HCl (2分)
② 使水蒸气冷凝,减少进入浓硫酸的水量,保持持续的吸水性,并降低放出的热量(2分)
(4) ① b c d(1分)
② 温度高,反应速率快;与前两个反应比较,更易于使硅分离,使化学平衡向右移动,提高转化率。(2分)
③ 208.8 (1分)
(5) SiO2 +6HF = H2SiF6 + 2H2O (2分)
解析试题分析:石英砂主要成分是SiO2,被碳还原为粗硅,与氯气化合得到SiCl4,在被还原得高纯硅。SiCl4水解生成的酸根据复分解原理,可推知为盐酸;(4)①a、升高温度,平衡逆向移动,降低SiCl4的转化率,错误;b、锌做还原剂应在无氧的条件下进行,正确;c、增大压强,平衡正向移动,提高SiCl4的转化率,正确;d、Na、Mg的还原性强,可以代替锌,正确。③每投入1mol SiCl4,反应2摩尔锌,热量为332kJ,利用率为90%,可计算出结果208.8kJ。
考点:考查化学工艺流程、氧化还原反应、方程式的书写、盖斯定律


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:填空题
工业上利用氨催化氧化后,经过一系列反应可以制备硝酸。
(1)氨气催化氧化的化学方程式为 _
(2)某工厂排出的尾气中NOx的含量为0.56%(体积分数),用氨气可以将其转化为无害气体,发生的反应为:6NOx+4xNH3=(3+2x)N2+6xH2O 若处理1×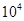 L(标准状况)该尾气需42.5gNH3,则x= _ 。
L(标准状况)该尾气需42.5gNH3,则x= _ 。
(3)NO和CO都是汽车尾气中的有害物质,必须进行处理。为避免污染,常给汽车安装尾气净化装置。净化装置里装有催化剂,气体在催化剂表面吸附与解吸作用的机理如图所示。写出净化过程中的总化学反应方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氯及其化合物是中学化学中的重要研究对象之一。
(1)在实验室中常用二氧化锰和浓盐酸制取氯气,写出有关反应的离子方程式______________________;
(2)实验室也可以利用如下反应制取氯气:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O。若用该反应制取标准状况下1.344 L氯气,反应过程中转移电子的物质的量为_________;
(3)某同学用排空气法收集一瓶氯气并进行氯气与铁反应的实验:取一根细铁丝,用砂纸将铁丝擦至光亮,用坩埚钳夹住,在酒精灯上烧至红热,铁丝保持红热,然后立即伸入充满氯气的集气瓶中,观察到的现象是______________________。向反应后的集气瓶中加入适量的蒸馏水,振荡,然后向所得溶液中滴加亚硫酸钠溶液,再滴加氯化钡溶液发现溶液变浑浊。写出上述反应的离子方程式:___________________ 、_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
近年来,许多专家对石灰氮重新进行了深入研究,这也使得石灰氮这一古老的肥料又焕发了新的活力。石灰氮是由Ca、N、C等三种元素组成的盐,其含钙、氮的质量分数分别为50%、35%。石灰氮完全水解后的产物是固体A和气体B,其中B是制取氮肥的主要原料。固体A在高温下分解生成D和气体C。B的催化氧化产物为E和F,F继续氧化后的产物G遇到E生成一种工业强酸。将G和F的混合物溶解在接近零度的水中,即生成亚硝酸的水溶液,该反应可表示如下G+F+H2O=2HNO2(已配平)。请回答下列问题:
(1)石灰氮的化学式为 。
(2)足量B和C与饱和氯化钠溶液的反应是化工生产中生产某种重要化工产品的重要反应,试写出其化学方程式 。
(3)亚硝酸(HNO2)是一种与醋酸酸性相当的弱酸,很不稳定,通常在室温下立即分解。在酸性条件下,当NaNO2与KI按物质的量1:1恰好完全反应,且I— 被氧化为I2时,含氮产物为 (填化学式)。要得到稳定HNO2溶液,可以往冷冻的浓NaNO2溶液中加入或通入某种物质,下列物质中不适合使用是 (填序号)。
a、磷酸 b、二氧化碳 c、稀硫酸 d、二氧化硫 e、次氯酸
(4)工业废水中的NO2— 可用铝粉除去。已知此反应体系中包含Al、NaAlO2、NaNO2、NaOH、NH3、H2O六种物质。写出上述反应的离子方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某同学探究SO2有关性质。
(1)将SO2通入BaCl2溶液中,将所得溶液分成2份,在第一份中加入NaOH溶液,在第二份中滴入FeCl3溶液,两份都有白色沉淀。BaCl2溶液中通入SO2气体的现象为 。在第二份溶液中滴入FeCl3溶液时,SO2表现 性,反应的离子方程式为 ,生成沉淀的化学式为 。
(2)下列不能用来吸收SO2气体的是 。
| A.KMnO4(aq) | B.过量氨水 | C.石灰水 | D.盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
用氮化硅(Si3N4)陶瓷代替金属制造发动机的耐热部件,能大幅度提高发动机的热效率。工业上用化学气相沉积法制备氮化硅,反应如下:
3SiCl4 +2N2 +6H2 Si3N4 +12HCl
Si3N4 +12HCl
完成下列填空:
(1)氮化硅可用于制造发动机的耐热部件,因为它属于 晶体。有关氮化硅的上述反应中,原子最外层只有一个未成对电子的元素是 (填写元素符号);属于非极性分子的化合物的电子式是 。
(2)比较Si和Cl两种元素非金属性强弱的方法是 。
a.比较两种元素的气态氢化物的沸点
b.比较两种元素的原子获得一个电子时释放能量的大小
c.比较两种元素的原子达到稳定结构获得电子的多少
d.比较相同条件下两种元素氢化物水溶液的酸性强弱
(3)Si与Al、Be具有相似的化学性质,因为 (简述理由),写出Si与强碱溶液反应的离子反应方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
随着世界粮食需求量的增加,农业对化学肥料的需求越越大。氮肥是需求最大的一种化肥。氮肥的生产和合理施用在农业生产中起着重大作用。合成氨及化肥生产流程示意图如下: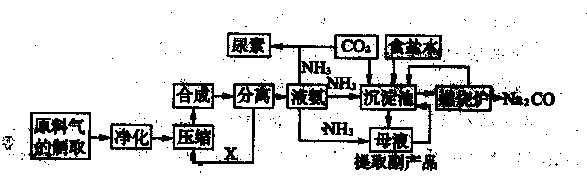
(1)目前,工业上用铁触媒作催化剂,在20~50 MPa、450℃左右用氮、氢混合气体在
中进行合成氨。则沿X方向回去的物质是 。
(2)在侯氏制碱法中,从沉淀池中得到的母液要通人氨气、降温并加入 (填化学式),目的是 。
(3)沉淀池中的化学方程式是 。
(4)工业上将氨催化氧化可制硝酸。在硝酸生产中,催化剂铂网在氨的催化氧化反应中起的作 用是 。硝酸工业尾气对环境污染严重,若在催化剂存在下用甲烷将其中的一氧化氮还原为对空气无污染的物质,其反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(15分)原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)X元素符号是 ;
(2)Z、W形成的气态氢化物的稳定性_______>_______(写化学式)。
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,离子方程式为___________。
(4)由X、Y、Z、W四种元素组成的一种离子化合物A,已知①1mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体。②A能与盐酸反应产生气体,该气体能与氯水反应,写出该气体与氯水反应的离子方程式_____________________。
(5)由X、Y、Z、W和Fe五种元素组成的相对分子质量为392的化合物B,lmolB中含有6mol结晶水。对化合物B进行如下实验:
A.取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体;过一段时间白色沉淀变为灰绿色,最终变为红褐色。
B.另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解。
①由实验a、b推知B溶液中含有的离子为__________________;
②B的化学式为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com