
| B | C |
| D |
| A. | 简单离子的半径大小关系:C>E | |
| B. | D元素的气态氢化物比C元素的气态氢化物稳定 | |
| C. | 由A、B、C三种元素组成的离子化合物中,阴、阳离子个数比为1:1 | |
| D. | 由C、D、E三种元素组成的化合物只有一种 |
分析 A、B、C、D、E均为短周期主族元素,A是短周期中原子半径最小的元素,A为H元素;E是短周期中最活泼的金属元素,E为Na元素;A、B、C三种元素的原子序数之和等于D元素的原子序数,结合B、C、D在周期表中的位置,设C的原子序数为x,则1+x-1+x=x+8,则x=8,即B为N,C为O,D为S,以此来解答.
解答 解:由上述分析可知,A为H,B为N,C为O,D为S,E为Na,
A.具有相同电子排布的离子中,原子序数大的离子半径小,则简单离子的半径大小关系:C>E,故A正确;
B.非金属性O>S,则D元素的气态氢化物不如C元素的气态氢化物稳定,故B错误;
C.由A、B、C三种元素组成的离子化合物为硝酸铵,阴、阳离子个数比为1:1,故C正确;
D.由C、D、E三种元素组成的化合物有硫酸钠、亚硫酸钠等,故D错误;
故选BD.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、原子序数推断元素为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 我国古代四大发明之一黑火药由硫酸、硝酸和木炭按一定比例混合制成 | |
| B. | PH计不能用于酸碱中和滴定终点的判断 | |
| C. | 石油的分馏,煤的干馏、气化、液化均是物理变化 | |
| D. | 可用蘸浓盐酸的棉棒检验输送氨气的管道是否漏气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | C-O | C≡C | H-O | C-H |
| E/(KJ.mol-1) | 436 | 343 | x | 465 | 413 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ⑤ | |||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ |
 ;元素⑨形成的氢化物的电子式
;元素⑨形成的氢化物的电子式 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 溶解烧渣选用足量酸,可以从常见的强酸中选择任意一种,试剂X选用铁粉 | |
| B. | 固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2 | |
| C. | 从溶液2得到FeSO4•7H2O产品的过程中,只需要缓慢加热至溶液出现少量晶体,停止加热利用余热蒸干即可 | |
| D. | 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4•7H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
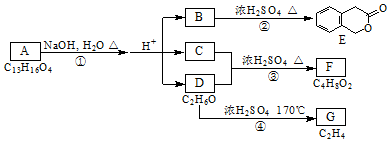
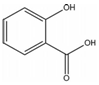 ,其名称为:邻羟基苯甲酸
,其名称为:邻羟基苯甲酸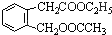 ④反应的反应类型是消去反应
④反应的反应类型是消去反应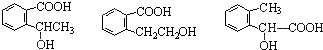 任意一个
任意一个 或CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH.
或CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属原子间以共价键结合的物质一定是共价化合物 | |
| B. | 含有共价键的化合物一定是共价化合物 | |
| C. | 凡是能电离出离子的化合物一定是离子化合物 | |
| D. | 凡是含有离子键的化合物一定是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 化学式 | 电离常数 |
| CH3COOH | K=1.7×10-5 |
| HCN | K=4.9×10-10 |
| H2CO3 | K1=4.3×10-7,K2=5.6×10-11 |
| A. | H2CO3、HCO3-、CH3COO-、CN- | B. | HCO3-、CH3COOH、CN-、CO32- | ||
| C. | HCN、HCO3-、CN-、CO32- | D. | HCN、HCO3-、CH3COO-、CN- |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | c(Na+)>2c(CO32-) | B. | c(Na+)=2 | ||
| C. | c(Na+)>c(CO32-)>c(OH-)>c(H+) | D. | c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com