
【题目】![]() 在工业上可作蓄电池中良好的正极材料。以废铅蓄电池拆解出来的“铅泥”(主要成分为
在工业上可作蓄电池中良好的正极材料。以废铅蓄电池拆解出来的“铅泥”(主要成分为![]() ,另有少量Pb、
,另有少量Pb、![]() 和
和![]() 等)为原料制备
等)为原料制备![]() 的一种工艺流程如图所示:
的一种工艺流程如图所示:
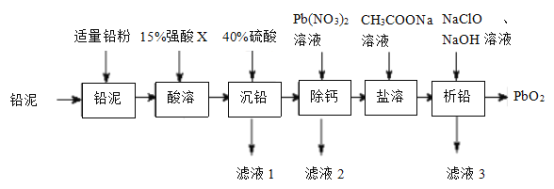
已知:i.常温下,单质铅与盐酸或硫酸几乎都不反应。
ii.铅盐中,(CH3COO)2Pb、Pb(NO3)2均易溶于水,![]() 难溶于水。
难溶于水。
请回答下列问题:
(1)“酸溶”时,Pb和PbO2转化为可溶性Pb2+盐,则“酸溶”时所用的强酸X为____;此条件下的氧化性:X___PbO2(选填“>”或“<”)
(2)用Pb(NO3)2溶液反复多次洗涤沉淀,以达到“除钙”的目的,其原理是_____________。
(3)(CH3COO)2Pb属于__________(选填“强电解质”或“弱电解质”);“滤液3”中除CH3COONa和NaClO外,所含钠盐主要还有___________(填化学式)
(4)“析铅”反应的离子方程式为____________________。
(5)从环境保护的角度分析,该工艺流程可能存在的缺点是_______________(任写一条)
(6)铅蓄电池中的电解液是H2SO4,放电后两个电极上均沉积有PbSO4。则放电时的负极反应式为___;充电时当电极上通过1mol电子,阳极的质量减少__________g。
【答案】硝酸(或HNO3); < PbSO4比CaSO4更难溶解,加入Pb(NO3)2溶液,可使CaSO4不断转化为PbSO4,Ca2+进入到溶液中 弱电解质 NaCl、Na2SO4 (CH3COO)2Pb+ClO-+2OH-=PbO2↓+Cl-+2CH3COO-+H2O “酸溶”时会产生大气污染物NOx(重金属铅盐可污染土壤或水源) Pb+SO42--2e-=PbSO4 32
【解析】
(1)“酸溶”的目的是将Pb、PbO2转化为可溶性Pb2+,而常温下,单质铅与盐酸或硫酸几乎都不反应,故所用的强酸应为硝酸;在有硝酸存在的环境下,PbO2转化为Pb2+,表现出氧化性,说明PbO2的氧化性比硝酸强,故答案为:硝酸(或HNO3);<;
(2)CaSO4的溶解平衡:CaSO4(s)![]() Ca2+(aq)+SO42-(aq),加入Pb(NO3)2溶液,Pb2+与SO42-结合成更难溶的PbSO4,使CaSO4的溶解平衡不断正向移动,最终完全溶解,达到“除钙”的目的,故答案为:PbSO4比CaSO4更难溶解,加入Pb(NO3)2溶液,可使CaSO4不断转化为PbSO4,Ca2+进入到溶液中;
Ca2+(aq)+SO42-(aq),加入Pb(NO3)2溶液,Pb2+与SO42-结合成更难溶的PbSO4,使CaSO4的溶解平衡不断正向移动,最终完全溶解,达到“除钙”的目的,故答案为:PbSO4比CaSO4更难溶解,加入Pb(NO3)2溶液,可使CaSO4不断转化为PbSO4,Ca2+进入到溶液中;
(3)“盐溶”时,加入CH3COONa可使PbSO4的溶解平衡正向移动,转化为(CH3COO)2Pb,说明(CH3COO)2Pb是弱电解质;“盐溶”后,溶液中含有(CH3COO)2Pb和Na2SO4,接下来“析铅”,加入NaClO、NaOH溶液,(CH3COO)2Pb转化为PbO2,Pb元素的化合价升高,推知NaClO转化为NaCl,Cl元素的化合价降低,因此“滤液3”中除CH3COONa和NaClO外,所含钠盐主要还有NaCl和Na2SO4,故答案为:弱电解质;NaCl、Na2SO4;
(4)“析铅”反应的离子方程式为:(CH3COO)2Pb+ClO-+2OH-=PbO2↓+Cl-+2CH3COO-+H2O,故答案为:(CH3COO)2Pb+ClO-+2OH-=PbO2↓+Cl-+2CH3COO-+H2O;
(5)“酸溶”阶段加入的HNO3会转化为NOx污染环境,铅是重金属,铅盐也会污染土壤或水源,故答案为:“酸溶”时会产生大气污染物NOx(重金属铅盐可污染土壤或水源);
(6)铅蓄电池的负极为Pb,放电时负极发生的反应为:Pb+SO42--2e-=PbSO4;充电时阳极发生反应:PbSO4-2e-+2H2O=PbO2+SO42-+4H+,当电极上通过1mol电子,阳极上有0.5molPbSO4转化为0.5molPbO2,质量减少32g,故答案为:Pb+SO42--2e-=PbSO4;32。


科目:高中化学 来源: 题型:
【题目】将物质X逐渐加入Y溶液中,生成沉淀物质的量n2与所加X的物质的量n1的关系如图所示。符合图所示情况的是
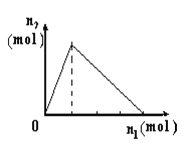
A | B | C | D | |
X | NaOH | AlCl3 | HCl | NaAlO2 |
Y | AlCl3 | NaOH | NaAlO2 | HCl |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol仅含C、H、O三种元素的有机物A在稀硫酸中水解生成1molB和1molC, B分子中N(C)∶N(H)=4∶5,135<Mr(B)<140;C与B分子中碳原子数相同,且Mr(B)=Mr(C)+2
(1)C的分子式为_____________________,
(2)B的分子具有高度对称性,苯环上的一氯取代物只有一种。B能与金属Na反应但不能与NaOH反应。写出B的结构简式_________________________;
(3)C有多种同分异构体,其中属于芳香族的酯类的同分异构体有_____________种;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是
A.侯氏制碱法:NH3+CO2+H2O=![]() +
+ ![]()
B.小苏打溶液与稀硫酸混合:![]() +2H+=CO2↑+H2O
+2H+=CO2↑+H2O
C.向Ba(OH)2溶液中加少量NaHCO3: ![]() +Ba2++OH-=BaCO3↓+H2O
+Ba2++OH-=BaCO3↓+H2O
D.硫酸亚铁溶液与过氧化氢溶液混合:Fe2++2H2O2+4H+=Fe3++4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组对一含有Al3+的未知溶液进行了如下分析:(1)滴加少量NaOH溶液,无明显变化;(2)继续滴加NaOH溶液,有白色胶状沉淀生成;(3)滴加过量的NaOH溶液,白色胶状沉淀明显减少。实验小组经定量分析,得出如图所示沉淀的物质的量与滴加NaOH溶液体积的关系。下列说法错误的是( )

A. 该未知溶液中至少含有3种阳离子
B. NaOH溶液的物质的量浓度为5 mol·L-1
C. 若另一种离子为二价阳离子,则a=10
D. 若将最终沉淀过滤、洗涤、灼烧,其质量一定为6 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】基于临床研究,抗疟疾药物磷酸氯喹被证实在治疗新冠肺炎过程中具有疗效。4,7-二氯喹啉是合成磷酸氯喹的一种中间体,其结构简式如图所示。下列有关该物质的说法不正确的是
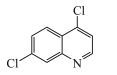
A.属于芳香族化合物B.分子中所有原子在同一平面上
C.分子式为C9H6NCl2D.可发生取代、加成、氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中FeCl3的水解反应已达平衡:FeCl3+3H2O![]() Fe(OH)3+3HCl,若要使FeCl3的水解程度增大,应该采用的方法是
Fe(OH)3+3HCl,若要使FeCl3的水解程度增大,应该采用的方法是
A. 加入NaHCO3B. 加入AgNO3固体
C. 加入FeCl3固体D. 降温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用生活中或实验中常见的物品,根据氧化还原反应知识和电化学知识,自己动手设计一个原电池。请填写下列空白:
(1)实验原理:Fe+2H+=Fe2++H2↑。
(2)实验原理:电极(______、______)、________、________、稀硫酸、耳机(或者电流计)。(请在空格中填写所缺的实验用品)
(3)实验装置(如图)。
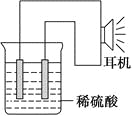
(4)原电池设计及注意的问题:
①按如图所示连接好实验仪器,注意观察(耳朵听)耳机是否有声音发出,如果没有,可将原电池的两个电极中的一极接触耳机插头上的一极(注意:接触的同时耳机的另一极是连接在原电池的另一个电极上的),这时可以听见耳机发出“嚓嚓嚓……”的声音。其原因是:在原电池中,由化学能转化为________,在耳机中又由________转化为声音这种能量。
②如果将装置中的耳机改为电流计,则铁钉应该接电流计的________极,电极反应是_____________________________,发生了________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知①R—Br![]() R—OH(R表示烃基);
R—OH(R表示烃基);
②苯环上原有的取代基对新导入的取代基进入苯环的位置有显著的影响;
③![]()
④![]()
以下是用苯作为原料制备一系列化合物的转化关系图:
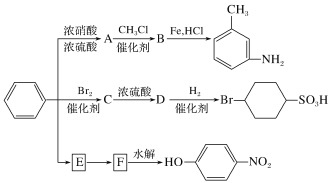
(1)A是一种密度比水___(填“大”或“小”)的无色液体,苯转化为A的化学方程式是________________。
(2)图中苯转化为E;E转化为F省略了条件,请写出E、F的结构简式:
E______________________________,F______________________________。
(3)在“苯![]() C
C![]() D
D![]()
![]() ”的转化过程中,属于取代反应的是___(填序号,下同),属于加成反应的是_____。
”的转化过程中,属于取代反应的是___(填序号,下同),属于加成反应的是_____。
(4)B分子中苯环上的任意两个氢被溴原子取代后,得到的二溴代物有________种同分异构体。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com