
【题目】已知Na2CO3与稀盐酸反应分两步进行:![]() +H+==
+H+==![]() ,
,![]() +H+= CO2↑+H2O。向10.00 mL 0.1000 mol·L-1Na2CO3溶液中滴加0.1000 mol·L-1盐酸,溶液pH随盐酸体积的变化如图。
+H+= CO2↑+H2O。向10.00 mL 0.1000 mol·L-1Na2CO3溶液中滴加0.1000 mol·L-1盐酸,溶液pH随盐酸体积的变化如图。
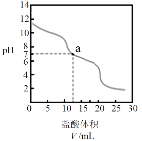
下列说法不正确的是
A.V = 5.00mL时,溶液中c(![]() )>c(
)>c(![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
B.V =10.00mL时,溶液中c(Na+)=c(![]() )+c(
)+c(![]() )+c(H2CO3)+c(Cl-)
)+c(H2CO3)+c(Cl-)
C.a点的溶液中:n(![]() )+n(
)+n(![]() ) = 0.001 mol
) = 0.001 mol
D.V = 20.00mL时,溶液pH<7,是因为H2CO3 ![]()
![]() + H+
+ H+
【答案】C
【解析】
A.V=5.00mL时,溶液中为Na2CO3、NaHCO3和NaCl,溶液呈碱性,说明此时溶液中OH-浓度大于H+,由于碳酸根水解能力大于碳酸氢根电离能力,故溶液中碳酸氢根浓度大于碳酸根浓度,故溶液中c(![]() )>c(
)>c(![]() )>c(OH-)>c(H+),A正确;
)>c(OH-)>c(H+),A正确;
B.V=10.00mL时,溶质为NaHCO3和NaCl,此时溶液中的物料守恒为c(Na+)=c(![]() )+c(
)+c(![]() )+c(H2CO3)+c(Cl-),B正确;
)+c(H2CO3)+c(Cl-),B正确;
C.a点的溶液,加入盐酸的体积大于10mL,此时溶液中的碳酸氢根与H+反应生成CO2溢出,故溶液中所有含碳元素形体的总物质的量小于0.001mol,C错误;
D.V=20.00mL时,此时溶液中的溶质全部为NaCl,但由于之前的反应有CO2生成,少量CO2溶于水生成碳酸,导致溶液pH<7,D正确;
故选C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】海水是一个巨大的化学资源宝库,下列有关海水综合利用的说法正确的是( )
A.海水中含有钠元素,只需经过物理变化就可以得到金属钠
B.海水蒸发制得粗盐,经提纯后再电解盐溶液可以得到金属钠
C.从海水中提纯到的食盐,电解饱和食盐水产生的产物可以制得“84”消毒液(NaClO)
D.可以通过物理方法直接从海水中提取溴单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4molA和4molB在2L的密闭容器中发生如下反应:2A(g)+B(g)=2C(g)+D(g)。前15s,A的平均反应速率为0.12mol·(L·s)1,则15s时,容器中B的物质的量为( )
A.2.2molB.3.2molC.1.8molD.2.8mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示的装置进行实验(夹持及尾气处理仪器略去),能达到实验目的的是
选项 | a中试剂 | b中试剂 | c中试剂 | 实验目的 | 装置 |
A | 氨水 | CaO | 无 | 制取并收集氨气 |
|
B | 浓盐酸 | MnO2 | 饱和NaCl溶液 | 制备纯净的Cl2 | |
C | 浓盐酸 | Na2CO3 | Na2SiO3溶液 | 比较酸性强弱: H2CO3>H2SiO3 | |
D | 浓硫酸 | Na2SO3 | KMnO4酸性溶液 | 验证SO2具有还原性 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应4NH3+5O2![]() 4NO+6H2O(g),下列叙述不正确的是 ( )
4NO+6H2O(g),下列叙述不正确的是 ( )
A.达到平衡时,4v(O2)正=5v(NO)逆
B.达到平衡状态后,NH3 、O2 、NO 、H2O(g)的物质的量保持不变。
C.达到平衡状态时,若增加容器体积,则反应速率增大
D.若单位时间生成xmolNO的同时,生成xmolNH3,则反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组为了探究CaCl2溶液和Na2SO4溶液反应有没有限度,设计了如下活动过程,请完成表中空格:(已知CaSO4在水中微溶,CaCO3在水中难溶)
实验步骤 | 向3-4 mL 1 mol/L的CaCl2溶液中滴入1mol/L的Na2SO4溶液至反应完全 |
实验现象 | _____________________ |
离子方程式 | _________________ |
小组讨论 交流 | 向上述反应后的清液中滴入适量1mol/L的Na2CO3 溶液会出现什么现象 |
对于实验现象提出的假设,说明理由 | 假设:①_____________________、②_______________________ 理由:①__________________、②_____________________。 |
实验证明你的假设 | 现象:____________________________________。 |
离子方程式 | _________________ |
解释 | _________________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是温度和压强对反应X+Y![]() 2Z影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )
2Z影响的示意图。图中横坐标表示温度,纵坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是( )

A.上述可逆反应的正反应为放热反应B.X、Y、Z均为气态
C.X和Y中最多只有一种为气态,Z为气态D.上述反应的逆反应的ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.28g乙烯与丙烯组成的混合物中含碳碳双键的数目为NA
B.2mol冰醋酸与4mol乙醇一定条件下充分反应,生成乙酸乙酯个数为2NA
C.室温时,1.0LpH=13的Ba(OH)2溶液中含有OH-的数目为0.1NA
D.标准状况下11.2LCl2溶于水,溶液中Cl-、ClO-和HClO的微粒数之和为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T℃时,体积均为0.5L的两个恒容密闭容器中发生可逆反应:2A(g)+B(g) ![]() 2C(g)△H=-QkJ/mol(Q>0)。保持温度不变,实验测得起始和平衡时的有关数据如下表:
2C(g)△H=-QkJ/mol(Q>0)。保持温度不变,实验测得起始和平衡时的有关数据如下表:
容器 编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
A | B | C | ||
① | 2 | 1 | 0 | 放热 0.75QkJ |
② | 0.4 | 0.2 | 1.6 | |
下列叙述中正确的是( )
A. 容器①、②中反应的平衡常数均为4
B. 容器②中达到平衡时放出的热量为0.05QkJ
C. 向容器①中通入氦气,平衡时A的转化率不变
D. 其他条件不变,若容器②保持恒容绝热,则达到平衡时C的体积分数小于2/3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com